Hvorfor er det ikke korrekt at tale om natriumchloridmolekyle?
* ionisk binding: Natriumchlorid dannes af den elektrostatiske tiltrækning mellem positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-). Disse ioner er arrangeret i et krystalgitter, uden forskellige, individuelle molekyler.
* Ingen diskrete enheder: I modsætning til molekyler, der holdes sammen af kovalente bindinger, mangler ioniske forbindelser diskrete enheder. Ionerne gentages kontinuerligt i en tredimensionel struktur.
* Formelenhed: Formlen NaCl repræsenterer det enkleste forhold mellem ioner i krystalgitteret, kendt som formelenheden.
I resumé, mens vi bruger udtrykket "natriumchlorid", som om det var et molekyle, er det mere nøjagtigt at referere til det som en ionisk forbindelse med en formelenhed af NaCl.
Sidste artikelSoliloquy overvejede, om denne metalloid eller ej?
Næste artikelHvad er smelte- og kogepunkterne for natrium?
 Varme artikler
Varme artikler
-
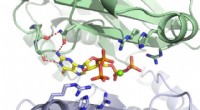 Metode til at undersøge, hvordan bakterier reagerer på sult, probe cellevækstEt MIT-hold har opdaget, at det lille molekyle ppGpp (rødt) binder til PurF-enzymet (underenheder vist i grønt og lilla). Kredit:Massachusetts Institute of Technology I 1969, videnskabsmand Michae
Metode til at undersøge, hvordan bakterier reagerer på sult, probe cellevækstEt MIT-hold har opdaget, at det lille molekyle ppGpp (rødt) binder til PurF-enzymet (underenheder vist i grønt og lilla). Kredit:Massachusetts Institute of Technology I 1969, videnskabsmand Michae -
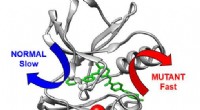 Computersimuleringer af proteiner hjælper med at opklare, hvorfor kemoterapiresistens opstårTredimensionel struktur af kræftlægemidlet Abl-kinase (grå) bundet til kræftlægemidlet imatinib. Normalt forlader lægemidlet langsomt via den blå pil. En modifikation i kinasen (rød kugle) får lægemid
Computersimuleringer af proteiner hjælper med at opklare, hvorfor kemoterapiresistens opstårTredimensionel struktur af kræftlægemidlet Abl-kinase (grå) bundet til kræftlægemidlet imatinib. Normalt forlader lægemidlet langsomt via den blå pil. En modifikation i kinasen (rød kugle) får lægemid -
 Sikker udskrivning med vandbaseret usynligt blækForskere i Kina har udviklet en omskrivbar papirbelægning, der kan kryptere hemmelig information med relativt lavteknologisk usynligt blæk-vand. En besked, der udskrives af en vandstråleprinter på et
Sikker udskrivning med vandbaseret usynligt blækForskere i Kina har udviklet en omskrivbar papirbelægning, der kan kryptere hemmelig information med relativt lavteknologisk usynligt blæk-vand. En besked, der udskrives af en vandstråleprinter på et -
 Et nyt MXene-materiale viser ekstraordinær elektromagnetisk interferensafskærmningsevneForskere ved Drexel og KIST rapporterede, at et nyt MXene-materiale, titanium carbonitrid, kan skærme den elektromagnetiske interferens bedre end materialer, der i øjeblikket anvendes i elektroniske e
Et nyt MXene-materiale viser ekstraordinær elektromagnetisk interferensafskærmningsevneForskere ved Drexel og KIST rapporterede, at et nyt MXene-materiale, titanium carbonitrid, kan skærme den elektromagnetiske interferens bedre end materialer, der i øjeblikket anvendes i elektroniske e


