Kan nitrogen danne en ionisk binding?
* Høj elektronegativitet: Nitrogen har en høj elektronegativitet (3,04 på Pauling -skalaen), hvilket betyder, at det stærkt tiltrækker elektroner. Dette gør det mere sandsynligt, at det får elektroner til at danne anioniske arter (som n³⁻) end at miste elektroner for at danne en kation.
* stor ioniseringsenergi: Det kræver en betydelig mængde energi at fjerne elektroner fra nitrogenatomer. Dette gør dannelsen af en positiv nitrogenion (N⁺) meget ugunstig.
Undtagelser:
Mens det er sjældent, er der nogle undtagelser:
* nitrider: Kvælstof kan danne ioniske forbindelser kaldet nitrider med stærkt elektropositive metaller som lithium, natrium og calcium. I disse forbindelser findes nitrogen som n³⁻ -anionen. For eksempel li₃n (lithiumnitrid).
Det er dog vigtigt at bemærke:
* Selv i nitrider betragtes bindingen ofte som delvist kovalent, hvilket betyder, at der er en vis grad af elektrondeling.
* Nitrogen er meget mere tilbøjelig til at danne kovalente bindinger, hvor det deler elektroner med andre atomer. Dette skyldes dets evne til at danne tredobbelt obligationer (som i N₂ gas) og dens tendens til at afslutte sin oktet ved at få tre elektroner.
Kortfattet:
Mens nitrogen teknisk kan danne ioniske bindinger i nogle tilfælde, er det meget mere almindeligt, at det danner kovalente bindinger på grund af dets høje elektronegativitet og stor ioniseringsenergi.
 Varme artikler
Varme artikler
-
 Forskere udvikler banebrydende røntgenteknik til at analysere gamle artefakterFotografier af arkæologiprøverne. Kredit:University of Leicester En banebrydende røntgenteknik, der kan analysere artefakter af enhver form eller tekstur på en ikke-destruktiv måde, er blevet udvi
Forskere udvikler banebrydende røntgenteknik til at analysere gamle artefakterFotografier af arkæologiprøverne. Kredit:University of Leicester En banebrydende røntgenteknik, der kan analysere artefakter af enhver form eller tekstur på en ikke-destruktiv måde, er blevet udvi -
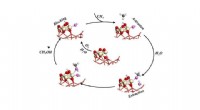 Vand er nøglen til katalytisk omdannelse af methan til methanolKatalytisk cyklus til selektiv omdannelse af methan til methanol ved at udsætte metanen for ilt og vand. Kredit:Brookhaven National Laboratory Forskere ved det amerikanske energiministerium Brookh
Vand er nøglen til katalytisk omdannelse af methan til methanolKatalytisk cyklus til selektiv omdannelse af methan til methanol ved at udsætte metanen for ilt og vand. Kredit:Brookhaven National Laboratory Forskere ved det amerikanske energiministerium Brookh -
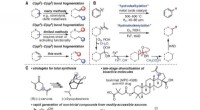 En mere effektiv måde at spalte vedhængende olefiner fra terpener og lignende forbindelserKoncept og anvendelser af hydrodealkenylativ fragmentering af C(sp 3 )–C(sp 2 ) obligationer. (A) Dekonstruktiv fragmentering af C-C-bindinger. (B) Oversigt og foreslået mekanisme for hydrodealken
En mere effektiv måde at spalte vedhængende olefiner fra terpener og lignende forbindelserKoncept og anvendelser af hydrodealkenylativ fragmentering af C(sp 3 )–C(sp 2 ) obligationer. (A) Dekonstruktiv fragmentering af C-C-bindinger. (B) Oversigt og foreslået mekanisme for hydrodealken -
 Enzymer med succes indlejret i plastProduktion af en biofunktionaliseret film i forarbejdningspilotanlægget. Kredit:Fraunhofer IAP Generelt, plast bliver behandlet ved langt over hundrede grader celsius. Enzymer, derimod, kan normal
Enzymer med succes indlejret i plastProduktion af en biofunktionaliseret film i forarbejdningspilotanlægget. Kredit:Fraunhofer IAP Generelt, plast bliver behandlet ved langt over hundrede grader celsius. Enzymer, derimod, kan normal
- Fra superstjerne til mistænkt:Carlos Ghosns skør uge
- Hvor længe varer en solnedgang typisk?
- Når en baseballspiller kaster, overfører han kinetisk energi fra sin krop til i bolden, hvor komme…
- Hvorfor bevæger tingene sig mod jorden, men ikke mod mennesker?
- Hvad er den mindste himmelske krop i universet?
- Overdreven risikabel kredit stærkt forbundet med boligkrise i de seneste årtier, undersøgelse sig…


