Hvad er mere polært siliciumtetra -bromid eller hydrogencyanid?
polaritet er et mål for den ujævne fordeling af elektrondensitet inden for et molekyle. Det opstår som følge af forskelle i elektronegativitet mellem atomer.
Elektronegativitet er et atoms evne til at tiltrække elektroner mod sig selv i en kemisk binding.
Hydrogencyanid (HCN)
* polær kovalent binding: Carbon-nitrogenbindingen i HCN er en polær kovalent binding, fordi nitrogen er mere elektronegativ end kulstof. Dette skaber en delvis negativ ladning på nitrogenatomet og en delvis positiv ladning på carbonatomet.
* lineær geometri: Den lineære geometri af HCN giver mulighed for et netto -dipolmoment, da bindingsdipolerne ikke annullerer hinanden.
siliciumtetrabromid (sibr₄)
* polære kovalente obligationer: De silicium-brombindinger i sibr₄ er også polære kovalente bindinger, hvor brom er mere elektronegativ end silicium.
* tetrahedral geometri: Imidlertid resulterer den tetrahedrale geometri af sibr₄ i bindoledipolerne, der annullerer hinanden, hvilket resulterer i et ikke -polært molekyle.
Konklusion:
På grund af dets polære kovalente bindinger og lineær geometri har hydrogencyanid (HCN) et større dipolmoment og er derfor mere polær end siliciumtetrabromid (SIBR₄).
 Varme artikler
Varme artikler
-
 Forskere udvikler neuron-inspireret, højtydende telechelisk polymerKædearkitektur og anvendelser af den telecheliske polymer. Kredit:NIMTE Forskere ved Ningbo Institute of Materials Technology and Engineering (NIMTE) fra det kinesiske videnskabsakademi har foreslå
Forskere udvikler neuron-inspireret, højtydende telechelisk polymerKædearkitektur og anvendelser af den telecheliske polymer. Kredit:NIMTE Forskere ved Ningbo Institute of Materials Technology and Engineering (NIMTE) fra det kinesiske videnskabsakademi har foreslå -
 Effektiv elektrokatalytisk reduktion af nitrat til nitrogen:Lovende måde at fjerne nitrogen fra van…(a-b) SEM-billeder og (c) XRD-mønster af det elektroafsatte Cu2 O tynde film på ramme af Cu-skum; (d) HRTEM-billede af den som fremstillede Cu2 O tynde film. Kredit:Tang Haibin Ifølge et papir for
Effektiv elektrokatalytisk reduktion af nitrat til nitrogen:Lovende måde at fjerne nitrogen fra van…(a-b) SEM-billeder og (c) XRD-mønster af det elektroafsatte Cu2 O tynde film på ramme af Cu-skum; (d) HRTEM-billede af den som fremstillede Cu2 O tynde film. Kredit:Tang Haibin Ifølge et papir for -
 Ekstrem forbedring af carbonhydroforgasning via mekanokemiKulstofhydroforgasning i stor skala. a) Fyrretræ og trækul som tilberedt efter træpyrolyse. b) Hjemmelavet valsemølle med en 15-liters beholder. c) Sammenligning mellem småskala planetmølle og storsk
Ekstrem forbedring af carbonhydroforgasning via mekanokemiKulstofhydroforgasning i stor skala. a) Fyrretræ og trækul som tilberedt efter træpyrolyse. b) Hjemmelavet valsemølle med en 15-liters beholder. c) Sammenligning mellem småskala planetmølle og storsk -
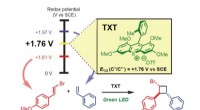 Lys skinner på kemisk produktionsmetodeBilledet illustrerer redoxpotentialet kontrolleret selektiv oxidation af styrener til regio- og stereoselektiv krydsede intermolekylære [2 + 2] cycloaddition via organophotoredox katalyse. Kredit:Yuji
Lys skinner på kemisk produktionsmetodeBilledet illustrerer redoxpotentialet kontrolleret selektiv oxidation af styrener til regio- og stereoselektiv krydsede intermolekylære [2 + 2] cycloaddition via organophotoredox katalyse. Kredit:Yuji
- Hvad menes med udtrykket human genpool?
- Udgravningssted i Toscana afslører, at neandertalere brugte ild til at lave værktøjer
- Hvad ville der ske med bølgelængden, hvis du kunne øge frekvensen af en periodisk bølge?
- Genomets 3D-struktur former, hvordan gener kommer til udtryk
- Hvordan kan astronomer opdage struktur i Suns -kromosfæren?
- Chrome til Windows med ARM-smag er velsmagende indsats for Microsoft, Google, Qualcomm


