Hvorfor smelter natriumchloridis og ikke sucrose?
natriumchlorid (NaCl):
* ionisk forbindelse: NaCl dissocierer i ioner (Na+ og Cl-), når de opløstes i vand. Disse ioner forstyrrer hydrogenbindingerne, der holder vandmolekyler sammen i is, hvilket sænker vandets frysepunkt.
* Kolligativ egenskab: Depressionen af frysepunktet forårsaget af NaCI er en kolligativ egenskab, hvilket betyder, at det afhænger af antallet af opløste partikler, ikke partiklernes art. Flere ioner betyder en større frysepunktdepression.
Sucrose (C12H22O11):
* kovalent forbindelse: Sucrose adskiller sig ikke i ioner, når de opløses i vand. Det forbliver som intakte molekyler.
* Ingen effekt på frysepunktet: Mens Sucrose opløses i vand, forstyrrer det ikke markant hydrogenbindingsnetværket i is, så det sænker ikke frysepunktet.
Kortfattet:
* NaCl: Opløser i ioner, forstyrrer hydrogenbinding i is og sænker frysepunktet.
* saccharose: Dissocieres ikke i ioner, forstyrrer ikke hydrogenbinding i is, har ubetydelig effekt på frysepunktet.
Derfor er NaCl effektiv til smeltende is, mens sucrose ikke er det.
Sidste artikelForklar, hvordan en kemisk binding dannes mellem kalium og klor?
Næste artikelHvor mange elektroner er der i et fosforatom?
 Varme artikler
Varme artikler
-
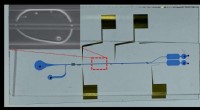 Mikrofluidisk system med celleadskillende kræfter kan afsløre, hvordan nye patogener angriberEt billede af den in-dråbe celleadskillelse mikrofluidisk chip, viser de mikrofluidiske kanaler og elektroder. Forstørret billede viser en værtscelle og patogene bakterieceller, der adskilles til top
Mikrofluidisk system med celleadskillende kræfter kan afsløre, hvordan nye patogener angriberEt billede af den in-dråbe celleadskillelse mikrofluidisk chip, viser de mikrofluidiske kanaler og elektroder. Forstørret billede viser en værtscelle og patogene bakterieceller, der adskilles til top -
 Nye lysdrevne katalysatorer kan hjælpe med fremstillingenMIT-kemikere har designet en ny type fotoredox-katalysator, der kan gøre det nemmere at inkorporere lysdrevne reaktioner i kontinuerlige produktionsprocesser. Polymerkatalysatorerne kunne bruges til a
Nye lysdrevne katalysatorer kan hjælpe med fremstillingenMIT-kemikere har designet en ny type fotoredox-katalysator, der kan gøre det nemmere at inkorporere lysdrevne reaktioner i kontinuerlige produktionsprocesser. Polymerkatalysatorerne kunne bruges til a -
 Video:Der er endelig (peer reviewed) kemi i vin- og madsammensætningerKredit:The American Chemical Society Rødvin passer til kød; hvidvin passer til fisk. Port går med Stilton. Drik aldrig vin efter at have spist artiskokker. Disse regler om, hvordan man parrer vin m
Video:Der er endelig (peer reviewed) kemi i vin- og madsammensætningerKredit:The American Chemical Society Rødvin passer til kød; hvidvin passer til fisk. Port går med Stilton. Drik aldrig vin efter at have spist artiskokker. Disse regler om, hvordan man parrer vin m -
 Forskere laver virusbekæmpende ansigtsmaskerGrafisk abstrakt. Kredit:ACS Applied Materials &Interfaces (2022). DOI:10.1021/acsami.2c04165 Forskere fra Rensselaer Polytechnic Institute har udviklet en tilgængelig måde at gøre N95-ansigtsmaske
Forskere laver virusbekæmpende ansigtsmaskerGrafisk abstrakt. Kredit:ACS Applied Materials &Interfaces (2022). DOI:10.1021/acsami.2c04165 Forskere fra Rensselaer Polytechnic Institute har udviklet en tilgængelig måde at gøre N95-ansigtsmaske
- Hvad er et eksempel på en varm stjerne, som ikke meget lys?
- Tre slags information fra en enkelt røntgenmåling
- Hvad fanger sollys for at give den nødvendige energi og lave mad?
- Ældste tilfælde af brystkræft og myelom afsløret i scanninger af mumier
- Hvorfor lever kvinder længere end mænd?
- Indrammet af køn:Kvindelige kunstnere slettet fra toppriser, salg på kunstauktioner


