Forklar, hvordan en kemisk binding dannes mellem kalium og klor?
forståelse af spillerne:
* kalium (k): Et alkalimetal, kalium har en elektron i sin yderste skal (valenselektron). Det mister let dette elektron for at opnå en stabil, fyldt ydre skal.
* klor (Cl): En halogen, klor har syv elektroner i sin yderste skal. Det har brug for endnu en elektron for at opnå en stabil, fyldt ydre skal.
den ioniske bindingsdannelse:
1. Elektronoverførsel: Når kalium- og chloratomer kommer tæt på, overføres kaliums enkelt valenselektron til klorens ydre skal.
2. iondannelse:
* Kalium, efter at have mistet et elektron, bliver en positivt ladet ion (K+).
* Klor, efter at have fået en elektron, bliver en negativt ladet ion (Cl-).
3. Elektrostatisk attraktion: De modsatte ladede ioner (K+ og Cl-) tiltrækkes af hinanden på grund af elektrostatiske kræfter. Denne stærke attraktion danner en ionisk binding .
4. Dannelse af KCL: Den elektrostatiske tiltrækning mellem kalium- og chloridioner skaber en stabil krystallinsk struktur kaldet kaliumchlorid (KCL). Denne struktur holdes sammen af de stærke kræfter mellem de modsatte ladede ioner.
Nøglepunkter:
* Ioniske bindinger dannes ved fuldstændig overførsel af elektroner mellem atomer.
* De resulterende ioner holdes sammen af elektrostatisk tiltrækning.
* Ioniske forbindelser har typisk høje smelte- og kogepunkter på grund af de stærke ioniske bindinger.
* Kaliumchlorid er et almindeligt salt, der bruges i forskellige anvendelser, herunder gødning og fødevaretilsætningsstoffer.
Kortfattet: Den stærke elektrostatiske attraktion mellem den positivt ladede kaliumion (K+) og den negativt ladede chloridion (Cl-) skaber den ioniske binding i kaliumchlorid (KCL).
 Varme artikler
Varme artikler
-
 Fluorescerende molekyler afsløret af kvantekemi og maskinlæringOtte forbindelser blev forudsagt at fluorescere ved en ny metode til design af molekyler. Af de otte blev seks fundet at fluorescere under ultraviolet lys (fem vist; C, D, E, F, G), inklusive en forbi
Fluorescerende molekyler afsløret af kvantekemi og maskinlæringOtte forbindelser blev forudsagt at fluorescere ved en ny metode til design af molekyler. Af de otte blev seks fundet at fluorescere under ultraviolet lys (fem vist; C, D, E, F, G), inklusive en forbi -
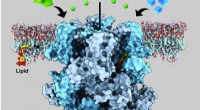 Form af struktur, som nerveceller bruger til at fornemme kulde og menthol, kunne være et nyt mål f…En ionkanal i humane nerveceller kaldet det forbigående receptorpotentielle melastatinelement 8 (TRPM8) registrerer både kulde og menthol, overføre kølende fornemmelser ved at frigive calcium (grønne
Form af struktur, som nerveceller bruger til at fornemme kulde og menthol, kunne være et nyt mål f…En ionkanal i humane nerveceller kaldet det forbigående receptorpotentielle melastatinelement 8 (TRPM8) registrerer både kulde og menthol, overføre kølende fornemmelser ved at frigive calcium (grønne -
 Detektering af ethylen, frugtmodningshormonetFigur viser den potentielle anvendelse af anvendelse af fluorescerende sonde til påvisning af ethylengas under modningsprocesser af frugter. I nærvær af ethylengas, fluoroforerne i proberne aktiveres
Detektering af ethylen, frugtmodningshormonetFigur viser den potentielle anvendelse af anvendelse af fluorescerende sonde til påvisning af ethylengas under modningsprocesser af frugter. I nærvær af ethylengas, fluoroforerne i proberne aktiveres -
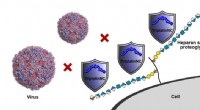 Metalbaserede forbindelser baner vejen for nye antivirale behandlingerTriplatinNC, repræsenteret i blåt, binder sig til celleoverfladereceptorer for at beskytte celler mod virusinfektion (her to enterovirus 71 partikler, repræsenteret til venstre). Kredit:Benjamin Baill
Metalbaserede forbindelser baner vejen for nye antivirale behandlingerTriplatinNC, repræsenteret i blåt, binder sig til celleoverfladereceptorer for at beskytte celler mod virusinfektion (her to enterovirus 71 partikler, repræsenteret til venstre). Kredit:Benjamin Baill
- Hvilke farver blandet sammen gør?
- Hvad er de mest almindelige kræfter vist i et gratis kropsdiagram?
- Tilpasning af fotosyntesemekanismer i luftplanter sker gennem genduplikation, viser undersøgelsen
- Hvordan er kraften nødvendig for at løfte en blokrelateret afstand, den bevæger sig?
- Invasiv kalve breder sig nordpå, truer Californias håndflader
- Urban oliebrønde forbundet med astma og andre sundhedsproblemer i Los Angeles


