Hvilket af følgende danner sandsynligvis en ionisk binding 1. kulstof og brint 2.Carbon svovl 3.Magnesium 4.nitrogen -ilt?
Forståelse af ioniske bindinger
Ioniske bindinger dannes mellem elementer med signifikant forskellige elektronegativiteter. Elektronegativitet er et atoms evne til at tiltrække elektroner i en binding.
* metaller Har generelt lav elektronegativitet og har en tendens til at miste elektroner og blive positivt ladede ioner (kationer).
* ikke -metaller har generelt høj elektronegativitet og har en tendens til at vinde elektroner og blive negativt ladede ioner (anioner).
analyse af parene
1. kulstof og brint: Begge er ikke -metaller, og deres elektronegativitetsforskel er ikke stor nok til at danne en ionisk binding. De danner kovalente obligationer.
2. kulstof og svovl: Begge er ikke -metaller, og selvom de har en større elektronegativitetsforskel end kulstof og brint, er det stadig ikke stort nok til en typisk ionisk binding. De danner kovalente obligationer.
3. magnesium og ilt: Magnesium er et metal (lav elektronegativitet), og ilt er en ikke -metal (høj elektronegativitet). Denne signifikante forskel i elektronegativitet fører til dannelse af en ionisk binding. Magnesium mister elektroner for at blive Mg²⁺, og ilt får elektroner til at blive O²⁻.
4. nitrogen og ilt: Begge er ikke -metaller. Mens de har en forskel i elektronegativitet, er den ikke stor nok til en typisk ionisk binding. De danner kovalente obligationer.
Konklusion
Parret er mest sandsynligt, at en ionisk binding er 3. Magnesium og ilt .
 Varme artikler
Varme artikler
-
 Forskere udvikler cellesugende teknologiPrikker i Histogram Feature Quantities svarer til hver celle. Vælg og klik på prikkerne på histogrammet for at bestemme, hvilke celler der skal suges. T baseret på de forudindstillede funktionsmængder
Forskere udvikler cellesugende teknologiPrikker i Histogram Feature Quantities svarer til hver celle. Vælg og klik på prikkerne på histogrammet for at bestemme, hvilke celler der skal suges. T baseret på de forudindstillede funktionsmængder -
 Integreret lab-on-a-chip bruger smartphone til hurtigt at opdage flere patogenerSystemet bruger en kommerciel smartphone til at erhverve og fortolke realtidsbilleder af en enzymatisk amplifikationsreaktion, der finder sted i en siliciummikrofluidisk chip, der genererer grøn fluor
Integreret lab-on-a-chip bruger smartphone til hurtigt at opdage flere patogenerSystemet bruger en kommerciel smartphone til at erhverve og fortolke realtidsbilleder af en enzymatisk amplifikationsreaktion, der finder sted i en siliciummikrofluidisk chip, der genererer grøn fluor -
 Forskere udvikler kemisk reaktionsmetode til mere effektiv lægemiddelproduktionLigesom en paddes udvikling, molekyler kan omdannes til polyenunderstrukturer, der er byggesten, der er nødvendige for antibiotika og kræftbehandlingsmidler. Kredit:Masafumi Hirano. TUAT Forskere
Forskere udvikler kemisk reaktionsmetode til mere effektiv lægemiddelproduktionLigesom en paddes udvikling, molekyler kan omdannes til polyenunderstrukturer, der er byggesten, der er nødvendige for antibiotika og kræftbehandlingsmidler. Kredit:Masafumi Hirano. TUAT Forskere -
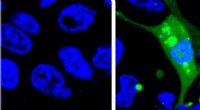 Ny, mere følsom sensor til vurdering af lægemiddelsikkerhedBillede af celler, der udtrykker AgHalo -sensoren før (venstre) og efter (højre) cellestress. AgHalo -sensoren tændes, når fejlfoldede proteiner begynder at aggregeres og giver et kvantitativt mål for
Ny, mere følsom sensor til vurdering af lægemiddelsikkerhedBillede af celler, der udtrykker AgHalo -sensoren før (venstre) og efter (højre) cellestress. AgHalo -sensoren tændes, når fejlfoldede proteiner begynder at aggregeres og giver et kvantitativt mål for
- Hvad er accelerationen af en bold, der går ned ad rampen, der vejer 0,25 kg og skubbes med 1,15N …
- Ordnet arrangeret perlekæde ternære nanokompositter til superkondensatorer
- Undersøgelse af tendenser inden for kunstig intelligens finder fremskridt i arbejdet med menneskeli…
- Hvilke områder skal Canada beskytte for at redde arter med risiko for at uddø?
- Hvorfor langsomt hældende kaffe gør et tårn af væske i din kop
- Udvendt design udvider bredspektrede superkameraegenskaber


