Kemisk reaktion af K3FECN6 i CH3COOH?
Faktorer ved spil:
* surhed: Eddikesyre er en svag syre, og K3FE (CN) 6 er et salt. Reaktionen vil blive påvirket af pH i opløsningen.
* stabiliteten af komplekset: Ferricyanidion [Fe (CN) 6] ³⁻ er et temmelig stabilt kompleks, hvilket betyder, at det ikke let er nedbrudt.
* redoxpotentiale: Der er en mulighed for redoxreaktioner, der involverer Fe (III) i ferricyanidionen, men det afhænger af forholdene.
Mulige reaktioner:
1. Ingen reaktion: Det er muligt, at reaktionen under milde forhold (lav koncentration af eddikesyre, stuetemperatur) ikke er signifikant. Ferricyanidionen forbliver muligvis stort set intakt.
2. delvis hydrolyse: Eddikesyre kunne delvist protonere ferricyanidionen, men reaktionen kan være reversibel:
[Fe (CN) 6] ³⁻ + H⁺ ⇌ [Fe (CN) 5 (H2O)] ²⁻ + CN⁻
3. redoxreaktioner: Hvis opløsningen er mere sur eller opvarmet, kan ferricyanidionen potentielt gennemgå reduktion til ferrocyanidion [Fe (CN) 6] ⁴⁻. Dette ville dog sandsynligvis kræve et reduktionsmiddel, der er til stede i opløsningen.
generelt:
Reaktionen af K3FE (CN) 6 i CH3COOH er ikke en enkel, veldefineret reaktion. Det specifikke resultat afhænger af faktorer som koncentration, temperatur og tilstedeværelsen af andre reagenser.
Vigtige noter:
* sikkerhed: Det er vigtigt at håndtere K3FE (CN) 6 med omhu, da det kan være giftigt. Arbejd altid i et godt ventileret område og brug passende sikkerhedsforholdsregler.
* Yderligere undersøgelse: Hvis du er interesseret i et specifikt aspekt af reaktionen, skal du muligvis konsultere en kemisk lærebog eller forskningsartikel for en mere detaljeret forklaring.
Fortæl mig, hvis du har andre spørgsmål om kemiske reaktioner!
Sidste artikelEr atomer konserveret i kemiske reaktioner?
Næste artikelHvilken type ladning har en natriumion?
 Varme artikler
Varme artikler
-
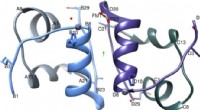 Ny forskning kan føre til flere behandlingsmuligheder for diabetespatienterIGlu-dimer med den to-foldede akse (grøn pil), A-kæden er farvet lysegrå, B-kæde i lyseblå, C-kæde i mørkegrå og D-kæde i lilla. Figur oprettet ved hjælp af Chimera v1.8.1 cgl.ucsf.edu/chimera/. Kredi
Ny forskning kan føre til flere behandlingsmuligheder for diabetespatienterIGlu-dimer med den to-foldede akse (grøn pil), A-kæden er farvet lysegrå, B-kæde i lyseblå, C-kæde i mørkegrå og D-kæde i lilla. Figur oprettet ved hjælp af Chimera v1.8.1 cgl.ucsf.edu/chimera/. Kredi -
 Lavpris solcelledrevet vandfilter fjerner bly, andre forurenende stofferI en undersøgelse foretaget ved Princeton University, forskere placerede gelen i søvand, hvor den absorberede rent vand, efterlader forurenende stoffer. Forskerne placerede derefter gelen i solen, hvo
Lavpris solcelledrevet vandfilter fjerner bly, andre forurenende stofferI en undersøgelse foretaget ved Princeton University, forskere placerede gelen i søvand, hvor den absorberede rent vand, efterlader forurenende stoffer. Forskerne placerede derefter gelen i solen, hvo -
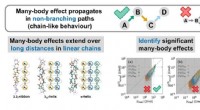 Hvornår er mange kropseffekter betydelige?(Øvre rude) Mange kropseffekter forekommer mest markant gennem kæder, ikke grene. (Nederst til venstre) De kooperative virkninger, der er de mest betydningsfulde, resulterer i den forbedrede stabilite
Hvornår er mange kropseffekter betydelige?(Øvre rude) Mange kropseffekter forekommer mest markant gennem kæder, ikke grene. (Nederst til venstre) De kooperative virkninger, der er de mest betydningsfulde, resulterer i den forbedrede stabilite -
 Undgåelige forbindelser af drivhusgasser isoleretKredit:University of Warwick Dinitrogenoxid (N 2 O) er et potent atmosfærisk forurenende stof. Selvom det forekommer naturligt, menneskeskabte N 2 O -emissioner fra intensiv landbrugsgødskning
Undgåelige forbindelser af drivhusgasser isoleretKredit:University of Warwick Dinitrogenoxid (N 2 O) er et potent atmosfærisk forurenende stof. Selvom det forekommer naturligt, menneskeskabte N 2 O -emissioner fra intensiv landbrugsgødskning
- Haster forberedelser, da supertyfonen nærmer sig Filippinerne
- Forskning kaster lys over vold og mental sundhed i brasilianske favelaer
- Klimaændringer driver hurtige skift mellem høje og lave vandstande på De Store Søer
- Hvilket stof er usædvanligt, fordi det udvider sig, når det går fra væske til fast stof?
- Har børn gavn af lektier?
- Hvad er lagene af rock lavet af?


