Hvorfor er uran reaktiv?
* stor atomstørrelse: Uran har en stor atomradius, hvilket betyder, at dens ydre elektroner er langt fra kernen. Dette gør det sværere for elektronerne at deltage i kemiske reaktioner.
* Høj ioniseringsenergi: Det kræver en masse energi at fjerne elektroner fra uranatomer. Dette gør det mindre sandsynligt, at det mister elektroner og danner positive ioner, som er nødvendige for mange kemiske reaktioner.
* stabil elektronkonfiguration: Uran har en relativt stabil elektronkonfiguration, som bidrager til dens samlede stabilitet.
* beskyttende oxidlag: Når uran udsættes for luft, danner det et beskyttende oxidlag på dets overflade. Dette lag forhindrer yderligere oxidation og beskytter uranen mod at reagere med andre stoffer.
Der er dog nogle vigtige advarsler:
* Radioaktivitet: Uran er radioaktivt, hvilket betyder, at dens kerne er ustabil og nedbrydes over tid og frigiver energi. Denne energi kan bruges til at starte kemiske reaktioner, hvilket gør uran * indirekte * reaktiv i nogle scenarier.
* reaktion med stærke oxidationsmidler: Mens uran er relativt ureaktivt under normale forhold, kan det reagere med stærke oxidatorer som fluor, klor og salpetersyre. Dette skyldes, at disse oxidatorer kan overvinde stabiliteten af uranatomet og tvinge det til at miste elektroner.
* fission: Når uran bombarderes med neutroner, kan det gennemgå nuklear fission, opdele i mindre atomer og frigive en enorm mængde energi. Denne proces er grundlaget for atomkraft og våben.
Så selvom uran ikke er så reaktivt som nogle andre elementer, udviser det stadig reaktivitet under specifikke forhold, primært på grund af dens radioaktivitet og dens evne til at reagere med stærke oxidationsmidler.
Sidste artikelHvad er ilt sammensat af?
Næste artikelHvad hedder denne forbindelse NACO3 x 10H2O?
 Varme artikler
Varme artikler
-
 Opdagelsen kan føre til bæredygtig ethanol fremstillet af kuldioxidAtomer på overfladen af kobber (751) er relativt langt fra hinanden sammenlignet med andre kobberkrystaller. Det kunne forklare, hvorfor kobber (751) er langt mere selektivt til at producere ethanol
Opdagelsen kan føre til bæredygtig ethanol fremstillet af kuldioxidAtomer på overfladen af kobber (751) er relativt langt fra hinanden sammenlignet med andre kobberkrystaller. Det kunne forklare, hvorfor kobber (751) er langt mere selektivt til at producere ethanol -
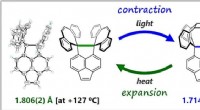 Kulstof-kulstof kovalente bindinger langt mere fleksible end antagetMolekylerne syntetiseret og analyseret af forskergruppen. I grøn og blå er den fleksible C-C enkeltbinding (Takuya Shimajiri, Takanori Suzuki, Yusuke Ishigaki, Angewandte Chemie International Edition,
Kulstof-kulstof kovalente bindinger langt mere fleksible end antagetMolekylerne syntetiseret og analyseret af forskergruppen. I grøn og blå er den fleksible C-C enkeltbinding (Takuya Shimajiri, Takanori Suzuki, Yusuke Ishigaki, Angewandte Chemie International Edition, -
 Ny metode til at fjerne olie fra vandEn dråbe råolie på en vandoverflade adsorberes inden for få sekunder af et blad af den flydende bregne Salvinia og trækkes op af vandet. Kredit:W. Barthlott, M. Mail/Uni Bonn Olie udgør en betydel
Ny metode til at fjerne olie fra vandEn dråbe råolie på en vandoverflade adsorberes inden for få sekunder af et blad af den flydende bregne Salvinia og trækkes op af vandet. Kredit:W. Barthlott, M. Mail/Uni Bonn Olie udgør en betydel -
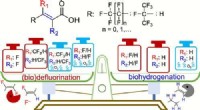 Under anaerobe forhold kan almindelige mikrobielle samfund bryde den ultra-stærke kulstof-fluor-bin…Kredit:Yaochun Yu et al., Environmental Science &Technology (2022). DOI:10.1021/acs.est.1c05509 Ingeniører ved University of California Riverside er de første til at rapportere selektiv nedbrydning
Under anaerobe forhold kan almindelige mikrobielle samfund bryde den ultra-stærke kulstof-fluor-bin…Kredit:Yaochun Yu et al., Environmental Science &Technology (2022). DOI:10.1021/acs.est.1c05509 Ingeniører ved University of California Riverside er de første til at rapportere selektiv nedbrydning


