Hvilke elementer ville have den største attraktion for elektroner. Bor eller ilt svovl?
* Elektronegativitet: Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner i en kemisk binding. Jo højere elektronegativitet, jo stærkere er det stærkere.
* Periodiske tendenser: Elektronegativitet øges, når du bevæger dig:
* på tværs af en periode (venstre til højre): Dette skyldes, at antallet af protoner i kernen øges og trækker elektronerne stærkere.
* op en gruppe (top til bund): Dette skyldes, at de yderste elektroner er tættere på kernen, hvilket gør attraktionen stærkere.
Lad os se på elementerne:
* bor (b): Placeret i gruppe 13 (3a) og periode 2
* ilt (O): Placeret i gruppe 16 (6a) og periode 2
* svovl (er): Placeret i gruppe 16 (6a) og periode 3
Konklusion:
* ilt (O) Har den største attraktion for elektroner. Det er i samme periode som bor, men længere til højre, hvilket betyder, at det har flere protoner og et stærkere træk på elektroner.
* svovl (r) er i den samme gruppe som ilt, men en periode lavere. Dette betyder, at det har en svagere attraktion for elektroner sammenlignet med ilt.
Derfor har ilt (O) den største attraktion for elektroner blandt bor, ilt og svovl.
Sidste artikelHvordan boratomer vil følge Octet -regel, og hvorfor?
Næste artikelHvilke 3 gasser er ansvarlige for at forårsage surt regn?
 Varme artikler
Varme artikler
-
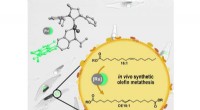 Alger som mikroskopiske bioraffinaderierKatalytisk olefinmetatese kan udføres i levende mikroalger. I denne proces omdannes fedtsyrer, der er lagret i algernes lipidorganeller, til polymerbyggesten og kemikalier. Kredit:Mecking Group Nog
Alger som mikroskopiske bioraffinaderierKatalytisk olefinmetatese kan udføres i levende mikroalger. I denne proces omdannes fedtsyrer, der er lagret i algernes lipidorganeller, til polymerbyggesten og kemikalier. Kredit:Mecking Group Nog -
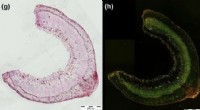 Selvhelbredende materialer inspireret af planterTværsnit af en Linum Drakkar stilk med et 26 dage gammelt sår parallelt med fibrene. Kredit:Cloé Paul-Victor, Albert-Ludwigs-Universitat Freiburg Forskere ved EPFLs Laboratory for Processing of Ad
Selvhelbredende materialer inspireret af planterTværsnit af en Linum Drakkar stilk med et 26 dage gammelt sår parallelt med fibrene. Kredit:Cloé Paul-Victor, Albert-Ludwigs-Universitat Freiburg Forskere ved EPFLs Laboratory for Processing of Ad -
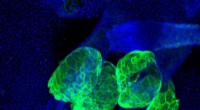 Forskere opdager en ny receptor, der regulerer talgkirtlens stamcellers funktionEmbigin-molekyle (grøn) er stærkt udtrykt i hudcellerne, der differentierer til talgkirtler. Cellernes kerner farves blå; de lange strukturer er hårsække. Kredit:Universitetet i Turku Stamceller og
Forskere opdager en ny receptor, der regulerer talgkirtlens stamcellers funktionEmbigin-molekyle (grøn) er stærkt udtrykt i hudcellerne, der differentierer til talgkirtler. Cellernes kerner farves blå; de lange strukturer er hårsække. Kredit:Universitetet i Turku Stamceller og -
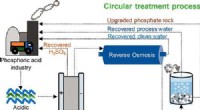 Forskere udvikler en metode til at omdanne farligt surt industrispildevand til værdifulde ressource…Kredit:ACS Sustainable Chemistry &Engineering (2022). DOI:10.1021/acssuschemeng.2c03132 Et forskerhold af miljøforskere fra Ben-Gurion University of the Negev har udviklet en cirkulær proces til at
Forskere udvikler en metode til at omdanne farligt surt industrispildevand til værdifulde ressource…Kredit:ACS Sustainable Chemistry &Engineering (2022). DOI:10.1021/acssuschemeng.2c03132 Et forskerhold af miljøforskere fra Ben-Gurion University of the Negev har udviklet en cirkulær proces til at
- Astronomer tager det første radioudseende efter beboelighed på fjerne planeter
- Fængsel, hvordan Stanford-eksperimentet fungerede
- Hvorfor et tungere rock falder hurtigere, når tyngdekraften er dobbelt så meget på to kg objektve…
- 0 K er lig med hvilken temperatur i Celsius?
- Hvilken planet ligger 2793 miles fra solen?
- Venedigs kanaler ryddes som by-turist-fri under coronavirus


