Hvordan bestemmer koncentrationerne af hydrogenion og hydroxid, om en opløsning er sur basisk eller neutral?
Begrebet pH
* ph: pH er et mål for surhedsgraden eller grundlæggende af en opløsning. Det er en logaritmisk skala, hvilket betyder, at hver hele antal ændringer repræsenterer en ti gange ændring i koncentrationen af brintioner.
* neutral: En neutral opløsning har en pH på 7. Dette betyder, at koncentrationerne af H+ og OH- er lige.
* Syre: Sure opløsninger har en pH mindre end 7. Dette betyder, at koncentrationen af H+ -ioner er større end koncentrationen af OH-ioner.
* grundlæggende (alkalisk): Grundlæggende opløsninger har en pH-værdi på mere end 7. Dette betyder, at koncentrationen af OH-ioner er større end koncentrationen af H+ -ioner.
forholdet
Nøglen til at forstå dette er ionproduktet af vand (KW):
* kW =[H+] [OH-] =1,0 x 10^-14 (ved 25 ° C)
Denne ligning angiver, at produktet af hydrogenionkoncentrationen og hydroxidionkoncentrationen altid er en konstant værdi (1,0 x 10^-14) ved en given temperatur. Denne konstante værdi repræsenterer ligevægtspunktet for vand.
hvordan det fungerer:
* neutral: Når [H+] =[OH-] =1,0 x 10^-7 m, er opløsningen neutral.
* Syre: Hvis [H+] er højere end 1,0 x 10^-7 m, skal [OH-] være lavere for at opretholde KW. Dette gør opløsningen sur.
* Grundlæggende: Hvis [OH-] er højere end 1,0 x 10^-7 m, skal [H+] være lavere for at opretholde KW. Dette gør løsningen grundlæggende.
Kortfattet:
En opløsnings surhed, basicitet eller neutralitet bestemmes af de relative koncentrationer af hydrogenioner (H+) og hydroxidioner (OH-). Jo højere koncentration af H+ -ioner er, jo mere sur opløsning. Jo højere koncentration af ohioner er, desto mere grundlæggende er løsningen. PH -skalaen giver en bekvem måde at udtrykke disse forskelle i koncentration.
Sidste artikelHvad er Elements Compound og Mixtures?
Næste artikelFryser alle stoffer til faste stoffer ved nul grader celsius?
 Varme artikler
Varme artikler
-
 Hvor ren er din patchouli?Kredit:CC0 Public Domain Indonesisk patchouliolie repræsenterer en betydelig andel af verdensmarkedet, leverer omkring 90 procent til parfumeindustrien som et almindeligt fiksativmiddel til dufte.
Hvor ren er din patchouli?Kredit:CC0 Public Domain Indonesisk patchouliolie repræsenterer en betydelig andel af verdensmarkedet, leverer omkring 90 procent til parfumeindustrien som et almindeligt fiksativmiddel til dufte. -
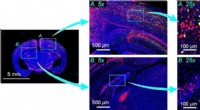 Optisk billeddannelsessystem kan fange et hidtil uset antal celler i et enkelt billedeFig.1:Billeddannelse af et musehjerneskive. Et flerfarvet billede af en musehjerneskive med to områder angivet med lyseblå firkanter, nemlig, hjernebarken (A) og hippocampus (B). Disse vises i hele-hj
Optisk billeddannelsessystem kan fange et hidtil uset antal celler i et enkelt billedeFig.1:Billeddannelse af et musehjerneskive. Et flerfarvet billede af en musehjerneskive med to områder angivet med lyseblå firkanter, nemlig, hjernebarken (A) og hippocampus (B). Disse vises i hele-hj -
 Automatisk syntese giver mulighed for opdagelse af uventet ladningstransportadfærd i organiske mole…Automatiseret synteseplatform i Molecule Marker Lab. Kredit:University of Illinois Urbana-Champaign Et tværfagligt team fra University of Illinois i Urbana-Champaign (UIUC) har demonstreret et stor
Automatisk syntese giver mulighed for opdagelse af uventet ladningstransportadfærd i organiske mole…Automatiseret synteseplatform i Molecule Marker Lab. Kredit:University of Illinois Urbana-Champaign Et tværfagligt team fra University of Illinois i Urbana-Champaign (UIUC) har demonstreret et stor -
 Krystallisation afklaret, rapporterer forskereProfessor Qian Chen, siddende, og kandidatstuderende Binbin Luo, venstre, og Zihao Ou samarbejdede med forskere ved Northwestern University for at observere og simulere dannelsen af krystallinske ma
Krystallisation afklaret, rapporterer forskereProfessor Qian Chen, siddende, og kandidatstuderende Binbin Luo, venstre, og Zihao Ou samarbejdede med forskere ved Northwestern University for at observere og simulere dannelsen af krystallinske ma
- Lys kan rejse gennem et vakuum, som det fremgår, når du ser solen eller månen. Kan lyde også?
- Hvordan en måne bremser forfaldet i Plutos -atmosfæren
- Er skorpen smeltepunktet lavere end den faktiske temperatur?
- Kulbrinter i den dybe jord?
- Hvorfor er bevægelserne fra atomer elliptiske?
- Magnetisk spin på ikke-magnetiske materialer


