Hvad er et molekyle, der absorberer hydrogenioner i opløsning?
Her er hvorfor:
* syrer Doner hydrogenioner (H+) til en opløsning.
* baser Accepter hydrogenioner (H+) fra en opløsning.
Denne proces kaldes protonation . Når en base accepterer en hydrogenion, bliver den protoneret.
Der er forskellige typer baser:
* Arrhenius baser Fremstil hydroxidioner (OH-) i opløsning, som derefter reagerer med brintioner for at danne vand.
* Brønsted-lowry baser er stoffer, der kan acceptere en proton (H+).
* lewis baser er elektronpardonorer og kan acceptere en proton ved at dele dets elektronpar med brintionen.
Eksempler på baser:
* natriumhydroxid (NaOH) er en stærk Arrhenius -base, der let donerer hydroxidioner.
* ammoniak (NH3) er en Brønsted-Lowry-base, der kan acceptere en proton til dannelse af ammoniumioner (NH4+).
* carbonationer (CO3^2-) er Lewis -baser, der kan donere elektronpar for at acceptere en proton.
Fortæl mig, hvis du gerne vil have flere oplysninger om specifikke typer baser!
Sidste artikelHvordan finder du de molekylære og empiriske formler?
Næste artikelHvilken alkali har en pH på 14?
 Varme artikler
Varme artikler
-
 Test af designet kulstofmaterialer til at rense spildevandKredit:CC0 Public Domain Affaldsstrømme fra industri og landbrug kunne bruges til produktion af kul, der kan tjene som en billig adsorbent til vandrensning. I sit speciale på Industridoktoralskole
Test af designet kulstofmaterialer til at rense spildevandKredit:CC0 Public Domain Affaldsstrømme fra industri og landbrug kunne bruges til produktion af kul, der kan tjene som en billig adsorbent til vandrensning. I sit speciale på Industridoktoralskole -
 Fysikere forklarer, hvordan store sfæriske vira dannesSiyu Li (til venstre) er kandidatstuderende i laboratoriet hos Roya Zandi, en professor i fysik ved UC Riverside. De ses her holde forskellige icosahedral strukturer. Kredit:I. Pittalwala, UC Riversid
Fysikere forklarer, hvordan store sfæriske vira dannesSiyu Li (til venstre) er kandidatstuderende i laboratoriet hos Roya Zandi, en professor i fysik ved UC Riverside. De ses her holde forskellige icosahedral strukturer. Kredit:I. Pittalwala, UC Riversid -
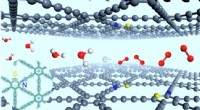 Forskere udvikler stereodefineret N- og S-atom-kodoperet grafdiyn til iltudviklingStereodefinerede sp-N- og S-atomer til effektiv iltudvikling. Kredit:Zhao Yasong Iltudviklingsreaktionen (OER) er af stor betydning i energirelaterede teknikker såsom metal-luft-batterier og vands
Forskere udvikler stereodefineret N- og S-atom-kodoperet grafdiyn til iltudviklingStereodefinerede sp-N- og S-atomer til effektiv iltudvikling. Kredit:Zhao Yasong Iltudviklingsreaktionen (OER) er af stor betydning i energirelaterede teknikker såsom metal-luft-batterier og vands -
 Computer redesigner enzymUniversitetet i Groningen videnskabsmænd Dr. Hein Wijma (til venstre) og Prof. Dr. Dick B. Janssen, som brugte en ny beregningsmetode til at redesigne aspartase-enzymet og omdanne det til en katalysat
Computer redesigner enzymUniversitetet i Groningen videnskabsmænd Dr. Hein Wijma (til venstre) og Prof. Dr. Dick B. Janssen, som brugte en ny beregningsmetode til at redesigne aspartase-enzymet og omdanne det til en katalysat
- Forskere finder lav genetisk diversitet hos tamfritter
- Efter jordskælvet mellem Iran og Irak, seismologer arbejder på at udfylde fejlkort over regionen
- Hvad er forskellen mellem et astronomisk teleskop og et galilisk teleskop?
- Hvad er en astrophyisist?
- Facebook siger, at der ikke er noget tegn, som den seneste hack spredte sig til andre apps
- Hvad er refraktion?


