Ved ligevægt har en opløsning af HF pH 5,4, hvis 1,2 x 10-6 og F- 3,5 Hvad er værdien Ka for ved denne temperatur?
Forstå ligevægten
* HF er en svag syre: Det ioniserer kun delvist i vand.
* ligevægt: Reaktionen når et punkt, hvor hastighederne for de fremadgående og omvendte reaktioner er ens.
* ka: Syredissocieringskonstanten, som repræsenterer, i hvilket omfang en syre ioniserer i opløsning.
Opsætning af istabellen
Vi bruger en is (initial, ændring, ligevægt) tabel til at spore koncentrationerne af de involverede arter:
| Arter | Indledende (i) | Ændring (c) | Ligevægt (E) |
| --- | --- | --- | --- |
| HF | | -x | |
| H+ | 0 | +x | |
| F- | 0 | +x | |
Beregninger
1. Find [H+] fra ph:
* ph =-log [H+]
* 5.4 =-log [H+]
* [H+] =10^-5,4 m
2. Bestem ændringen (x):
* Siden [H+] =x ved ligevægt, x =10^-5,4 m
3. Udfyld istabellen:
* Vi ved, at [F-] ved ligevægt er 3,5 m, og dette er lig med ændringen (X) plus den indledende koncentration af F-:
* 3.5 =x + [f-] initial
* [F-] initial =3,5 - x =3,5 - 10^-5,4 ≈ 3,5 m
* Nu kan vi udfylde resten af tabellen:
| Arter | Indledende (i) | Ændring (c) | Ligevægt (E) |
| --- | --- | --- | --- |
| HF | 1,2 x 10^-6 | -10^-5,4 | 1,2 x 10^-6-10^-5,4 |
| H+ | 0 | +10^-5.4 | 10^-5.4 |
| F- | 3.5 | +10^-5.4 | 3.5 |
4. Beregn Ka:
* Ka =([h+] [f-])/[hf]
* Ka =(10^-5,4 * 3,5) / (1,2 x 10^-6-10^-5,4)
* Ka ≈ 7,2 x 10^-4
Derfor er KA-værdien for HF ved denne temperatur ca. 7,2 x 10^-4.
 Varme artikler
Varme artikler
-
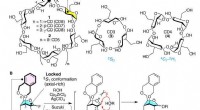 Forskere finder en måde at syntetisere små cyclodextriner påStrukturer af CDer og nøgleelementer muliggjorde syntese af 3 og 4. (A) På grund af de anstrengte glucopyranose-ringe i 3 og 4, deres eksistens blev anset for usandsynlig. (B) Konception af EDB-broen
Forskere finder en måde at syntetisere små cyclodextriner påStrukturer af CDer og nøgleelementer muliggjorde syntese af 3 og 4. (A) På grund af de anstrengte glucopyranose-ringe i 3 og 4, deres eksistens blev anset for usandsynlig. (B) Konception af EDB-broen -
 Vedligeholdelse af veje med drue og landbrugsaffaldXianming Shi tænkte først på at bruge bioteknologi til at udlede tilsætningsstoffer til affald fra landbrugsaffaldsmaterialer for flere år siden, da Alaskas transportministerium fik til opgave at udvi
Vedligeholdelse af veje med drue og landbrugsaffaldXianming Shi tænkte først på at bruge bioteknologi til at udlede tilsætningsstoffer til affald fra landbrugsaffaldsmaterialer for flere år siden, da Alaskas transportministerium fik til opgave at udvi -
 En corny løsning til at hjælpe med at bekæmpe spredningen af den nye coronavirusKarakteristisk for denne håndsprit kommer fra dens ethanolbase. Ethanol er en plantebaseret vedvarende energikilde-i USA primært fremstillet af majs-der ofte blandes med benzin til køretøjer. Kredit:U
En corny løsning til at hjælpe med at bekæmpe spredningen af den nye coronavirusKarakteristisk for denne håndsprit kommer fra dens ethanolbase. Ethanol er en plantebaseret vedvarende energikilde-i USA primært fremstillet af majs-der ofte blandes med benzin til køretøjer. Kredit:U -
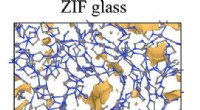 Forudsigelse af egenskaberne af en ny klasse af brillerBeregningsmodel af porøst ZIF-glas. Kredit:Yongjian Yang/Penn State ZIF briller, en ny glasfamilie, kunne kombinere gennemsigtigheden af silikatglas med den ikke-skøre kvalitet af metallisk glas
Forudsigelse af egenskaberne af en ny klasse af brillerBeregningsmodel af porøst ZIF-glas. Kredit:Yongjian Yang/Penn State ZIF briller, en ny glasfamilie, kunne kombinere gennemsigtigheden af silikatglas med den ikke-skøre kvalitet af metallisk glas
- Hvor hurtigt opløses sukker i vand og hvordan saltvand?
- Designer Nanomaterials On-Demand:Forskere rapporterer universel metode til oprettelse af nanoskala k…
- Sådan fungerer Pi
- NASA-data tyder på, at fremtiden kan blive mere regnfuld end forventet
- Undervisning af chatbots i almindeligt menneskesprog
- Hvordan kan egenskaber kun observeres, når stofferne i en prøve af stof ændrer sig til forskellig…


