Den energi, der kræves for at bryde bindingerne i 1 mol af en kemisk forbindelse?
Her er en sammenbrud:
* Bond -entalpi: Dette er den gennemsnitlige energi, der kræves for at bryde en bestemt type binding i et gasfasemolekyle. Det er en positiv værdi, fordi energi skal sættes i for at bryde bindingen.
* obligationsdissociation entalpi: Dette er den energi, der kræves for at bryde et specifikt binding i et molekyle, og det kan variere afhængigt af det specifikke molekyle og miljøet.
Nøglepunkter:
* enheder: Obligationsentalpi og obligationsdissociation -entalpi udtrykkes normalt i kilojoules pr. Mol (KJ/mol) .
* gennemsnit: Bond -entalpi er en gennemsnitlig værdi, da den faktiske energi, der kræves for at bryde en bestemt binding, kan variere lidt.
* gasfase: Bondthalpier måles typisk i gasfasen, da intermolekylære interaktioner i væsker og faste stoffer kan påvirke bindingsstyrker.
* forudsigelse af reaktioner: Bond enthalpier kan bruges til at estimere enthalpiændringen (varme absorberet eller frigivet) under en kemisk reaktion.
Fortæl mig, hvis du gerne vil have flere oplysninger om obligationsentalpier eller vil udforske specifikke eksempler!
 Varme artikler
Varme artikler
-
 Forskere gør et vigtigt fremskridt i retning af produktion af vigtigt biobrændstofGrafisk, der viser biobutanolseparationsmetode. Kredit:Oregon State University Et internationalt forskningssamarbejde har taget et vigtigt skridt i retning af den kommercielt levedygtige fremstill
Forskere gør et vigtigt fremskridt i retning af produktion af vigtigt biobrændstofGrafisk, der viser biobutanolseparationsmetode. Kredit:Oregon State University Et internationalt forskningssamarbejde har taget et vigtigt skridt i retning af den kommercielt levedygtige fremstill -
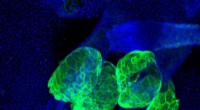 Forskere opdager en ny receptor, der regulerer talgkirtlens stamcellers funktionEmbigin-molekyle (grøn) er stærkt udtrykt i hudcellerne, der differentierer til talgkirtler. Cellernes kerner farves blå; de lange strukturer er hårsække. Kredit:Universitetet i Turku Stamceller og
Forskere opdager en ny receptor, der regulerer talgkirtlens stamcellers funktionEmbigin-molekyle (grøn) er stærkt udtrykt i hudcellerne, der differentierer til talgkirtler. Cellernes kerner farves blå; de lange strukturer er hårsække. Kredit:Universitetet i Turku Stamceller og -
 Ny 3D-trykningsteknik producerer levende 4-D materialerUNSW-forskere har kombineret 3D-print med en lysstyret proces for at skabe en levende 4D-harpiks. Kredit:Shutterstock Reparation og genbrug af plast og levering af kræftmedicin mere effektivt er k
Ny 3D-trykningsteknik producerer levende 4-D materialerUNSW-forskere har kombineret 3D-print med en lysstyret proces for at skabe en levende 4D-harpiks. Kredit:Shutterstock Reparation og genbrug af plast og levering af kræftmedicin mere effektivt er k -
 Maddikeanalyse går molekylært til retsmedicinske sagerKredit:CC0 Public Domain Maddiker på en død krop eller et sår kan hjælpe med at finde ud af, hvornår en person eller et dyr døde, eller når mishandling begyndte hos ældre, børnepasnings- eller dyr
Maddikeanalyse går molekylært til retsmedicinske sagerKredit:CC0 Public Domain Maddiker på en død krop eller et sår kan hjælpe med at finde ud af, hvornår en person eller et dyr døde, eller når mishandling begyndte hos ældre, børnepasnings- eller dyr
- Hvor er Hubble -teleskopet nu?
- Kunne en planet eksistere uden en værtsstjerne?
- Terrasatellit bekræfter Paulettes anden post-tropiske overgang
- NASA ser post-tropisk cyklon Helene påvirke Irland, Det Forenede Kongerige
- Washington Posts annonceteknologiske platform sigter mod Google-Facebook-duopol
- Hvad er en type rock, hvor stalaktitter og stalagmitter findes?


