Hvilket metal har mere end en oxidationstilstand?
* Overgangsmetaller: Overgangsmetaller, der er placeret i D-blokken i den periodiske tabel, er især kendt for at have flere oxidationstilstande. Dette skyldes deres evne til at miste elektroner fra både deres S og D -orbitaler. Eksempler inkluderer:
* jern (Fe): Fe (II) og Fe (III)
* kobber (CU): Cu (i) og Cu (II)
* mangan (MN): Mn (II), Mn (III), Mn (IV), Mn (VI) og Mn (VII)
* Andre metaller: Nogle ikke-overgangsmetaller udviser også variable oxidationstilstande. Eksempler inkluderer:
* tin (Sn): Sn (II) og Sn (IV)
* bly (PB): PB (II) og PB (IV)
Nøglefaktorer, der påvirker oxidationstilstande:
* Elektronisk konfiguration: Antallet af tilgængelige valenselektroner til binding bestemmer de mulige oxidationstilstande.
* ligander: De omgivende atomer eller molekyler (ligander) kan påvirke metalens oxidationstilstand.
* reaktionsbetingelser: Faktorer som temperatur, tryk og tilstedeværelsen af andre reaktanter kan påvirke stabiliteten i forskellige oxidationstilstande.
Eksempel:
Jern kan eksistere i både +2 og +3 oxidationstilstande:
* Fe (II): Fundet i forbindelser som jernoxid (FEO).
* Fe (III): Fundet i forbindelser som jernoxid (Fe₂o₃).
Fortæl mig, hvis du gerne vil udforske specifikke eksempler eller lære mere om, hvordan man forudsiger oxidationstilstande!
 Varme artikler
Varme artikler
-
 Fremme kreativitet hos forskere:Hvordan automatisering kan revolutionere materialeforskningKONTANTER, der kombinerer maskinlæring, robotteknologi, og big data demonstrerer det enorme potentiale inden for materialevidenskab. Det er kun gennem samevolution med sådanne teknologier, at fremtidi
Fremme kreativitet hos forskere:Hvordan automatisering kan revolutionere materialeforskningKONTANTER, der kombinerer maskinlæring, robotteknologi, og big data demonstrerer det enorme potentiale inden for materialevidenskab. Det er kun gennem samevolution med sådanne teknologier, at fremtidi -
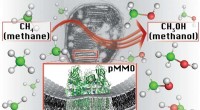 Metanforbrugende bakterier kan være fremtiden for brændstofDet primære metaboliske enzym i metanotrofe bakterier, partikelformig methanmonooxygenase (pMMO), katalyserer metan-til-methanol-omdannelsen på et sted med en kobberion. Kredit:Northwestern University
Metanforbrugende bakterier kan være fremtiden for brændstofDet primære metaboliske enzym i metanotrofe bakterier, partikelformig methanmonooxygenase (pMMO), katalyserer metan-til-methanol-omdannelsen på et sted med en kobberion. Kredit:Northwestern University -
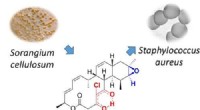 Antimikrobielt naturprodukt, der er aktivt mod både MRSA og malariaforårsagende parasitAnaloger af det naturlige produkt chlorotonil blev opnået ved semisyntese gennem regio- og stereoselektiv epoxidation og efterfølgende ringåbning. Derivaterne bibeholdt aktivitet mod multiresistente g
Antimikrobielt naturprodukt, der er aktivt mod både MRSA og malariaforårsagende parasitAnaloger af det naturlige produkt chlorotonil blev opnået ved semisyntese gennem regio- og stereoselektiv epoxidation og efterfølgende ringåbning. Derivaterne bibeholdt aktivitet mod multiresistente g -
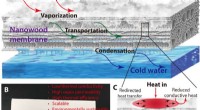 Ny træmembran giver et bæredygtigt alternativ til vandfiltreringSkematisk af processen med brug af den nye træmembran til destillering af vand. Kredit:T. Li, University of Maryland. Inspireret af det indviklede vandsystem, der cirkulerer i et træ, et team af f
Ny træmembran giver et bæredygtigt alternativ til vandfiltreringSkematisk af processen med brug af den nye træmembran til destillering af vand. Kredit:T. Li, University of Maryland. Inspireret af det indviklede vandsystem, der cirkulerer i et træ, et team af f
- Væske går til fast varmeforøgelse eller -tab?
- Forskere anvender twistronics til lysudbredelse og gør et gennembrud
- NASAs NavCube kunne støtte en røntgenkommunikationsdemonstration i rummet-en NASA først
- Diagram for at vise forholdet mellem celler og komplet organisme?
- Hvor mange joule varme skal der til for fuldstændigt at fordampe 24,40 gram vand ved dets kogepunkt…
- Hvad er betydningen af hurtigt?


