Hvor mange joule varme skal der til for fuldstændigt at fordampe 24,40 gram vand ved dets kogepunkt?
Vi kan bruge denne information til at beregne mængden af varme, der skal til for at fordampe 24,40 gram vand. Først skal vi beregne antallet af mol vand i 24,40 gram:
$$24,40 \text{ g H}_2\text{O} \times \frac{1 \text{ mol H}_2\text{O}}{18,02 \text{ g H}_2\text{O}} =1,354 \text{ mol H}_2\text{O}$$
Dernæst kan vi bruge fordampningsentalpien til at beregne mængden af varme, der er nødvendig for at fordampe denne mængde vand:
$$1,354 \text{ mol H}_2\text{O} \times 40,79 \text{ kJ/mol} =55,14 \text{ kJ}$$
Derfor kræver det 55,14 kJ varme at fordampe fuldstændigt 24,40 gram vand ved dets kogepunkt.
 Varme artikler
Varme artikler
-
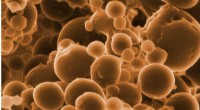 Vidensgab lukket i vores forståelse af nedbrydning af ethanDannelse af små vesikler indikerer, at Candidatus Argoarchaeum ethanivorans deler sig ved knopskydning. Forskerne opdagede disse strukturer med et højopløseligt helium-ionmikroskop. De arkæiske celler
Vidensgab lukket i vores forståelse af nedbrydning af ethanDannelse af små vesikler indikerer, at Candidatus Argoarchaeum ethanivorans deler sig ved knopskydning. Forskerne opdagede disse strukturer med et højopløseligt helium-ionmikroskop. De arkæiske celler -
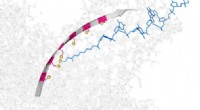 Molekylær tragt lille nok til at flytte enkelt DNA-strengeKredit:University of Oxford Forskere fra University of Oxford har konstrueret en molekylær beholder, i stand til at flytte enkeltstrenge af DNA gennem et protein nanorør. Den lille tragt fungere
Molekylær tragt lille nok til at flytte enkelt DNA-strengeKredit:University of Oxford Forskere fra University of Oxford har konstrueret en molekylær beholder, i stand til at flytte enkeltstrenge af DNA gennem et protein nanorør. Den lille tragt fungere -
 Leverer tryk med en ukonventionel krystalgrænsefladeKredit:Rensselaer Polytekniske Institut Brugen af tryk til at ændre halvlederegenskaber viser stigende lovende i applikationer som højtydende infrarøde sensorer og energikonverteringsenheder. Me
Leverer tryk med en ukonventionel krystalgrænsefladeKredit:Rensselaer Polytekniske Institut Brugen af tryk til at ændre halvlederegenskaber viser stigende lovende i applikationer som højtydende infrarøde sensorer og energikonverteringsenheder. Me -
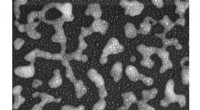 Kemisk sensing-chip opsnuser kokain inden for få minutterEt scanningselektronmikroskopbillede viser overfladen af en ny kemisk sensing-chip. Overfladen består af guld nanopartikler (små lyse prikker), der er blevet aflejret over sølv nanopartikler (lysegr
Kemisk sensing-chip opsnuser kokain inden for få minutterEt scanningselektronmikroskopbillede viser overfladen af en ny kemisk sensing-chip. Overfladen består af guld nanopartikler (små lyse prikker), der er blevet aflejret over sølv nanopartikler (lysegr
- Laboratorieteknologi giver klarhed blandt hawaiiansk vandforurening
- Kraftige røntgenstråler låser op for hemmeligheder bag krystaldannelse i nanoskala
- NASA-NOAAs satellit sporer en stærkere tropisk cyklon Owen, der nærmer sig landgang
- Spurvfald faldt i forbindelse med luftforurening og dårlig kost
- Faseændring i grafit ved grænsefladeladningsinjektion
- Sådan beregnes tryk i en tank


