Hvorfor er nitrogentrichloridmolekylet pyramidal form, men bortrigonal plan?
nitrogen trichlorid (NCL 3 ):
* nitrogens elektroniske konfiguration: Nitrogen har 5 valenselektroner. I NCL 3 , det danner tre enkeltbindinger med chloratomer ved hjælp af tre af dets valenselektroner. Dette efterlader et ensomt par elektroner på nitrogenatomet.
* VSEPR -teori: VSEPR -teorien siger, at elektronpar (både bindings- og ensomme par) omkring et centralt atom vil arrangere sig selv for at minimere frastødning. Dette betyder, at de fire elektronpar omkring nitrogen (tre bindingspar og et ensomt par) vedtager et tetrahedralt arrangement for at maksimere afstanden mellem dem.
* molekylær form: Da en af positionerne i det tetrahedrale arrangement er besat af et ensomt par, er den samlede molekylære form af NCL 3 bliver pyramidal (specifikt en trigonal pyramide).
bor trichlorid (BCL 3 ):
* Borons elektroniske konfiguration: Bor har 3 valenselektroner. I BCL 3 , det danner tre enkeltbindinger med chloratomer ved hjælp af alle dens valenselektroner. Det har ingen ensomme par.
* VSEPR -teori: Med tre bindingspar og ingen ensomme par omkring bor, vil elektronparre arrangere sig i en trigonal plan geometri for at minimere frastødning.
* molekylær form: Den molekylære form af BCL 3 er også trigonal plan Fordi arrangementet af bindingsparene direkte definerer den molekylære form.
Kortfattet:
* Tilstedeværelsen af et ensomt par på nitrogenatomet i NCL 3 får dens molekylære form til at være pyramidal, mens fraværet af ensomme par på bor i BCL 3 resulterer i en trigonal plan form.
Denne forskel i form afspejles også i deres respektive bindingsvinkler. CL-N-CL-bindingsvinklen i NCL 3 er lidt mindre end 109,5 ° (den ideelle tetrahedrale vinkel) på grund af frastødning fra det ensomme par, mens CL-B-CL-bindingsvinklen i Bcl 3 er nøjagtigt 120 °.
 Varme artikler
Varme artikler
-
 Vandledninger kan spille en større rolle i cellulær funktionKredit:CC0 Public Domain Hver af vores celler er omgivet af en kompleks membran, der fungerer som en biologisk grænse, lade ioner og næringsstoffer som salt, kalium og sukker ind og ud. Beskyttern
Vandledninger kan spille en større rolle i cellulær funktionKredit:CC0 Public Domain Hver af vores celler er omgivet af en kompleks membran, der fungerer som en biologisk grænse, lade ioner og næringsstoffer som salt, kalium og sukker ind og ud. Beskyttern -
 Ny proteinbilleddannelsesmetode baner vej for næste generations biomaterialer og vævsanalyseKredit:Unsplash/CC0 Public Domain Forskere har etableret en ny metode til billedproteiner, der kan føre til nye opdagelser i sygdomme gennem biologisk vævs- og celleanalyse og udvikling af nye bio
Ny proteinbilleddannelsesmetode baner vej for næste generations biomaterialer og vævsanalyseKredit:Unsplash/CC0 Public Domain Forskere har etableret en ny metode til billedproteiner, der kan føre til nye opdagelser i sygdomme gennem biologisk vævs- og celleanalyse og udvikling af nye bio -
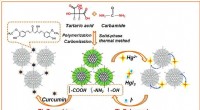 Hvordan nitrogen-doterede fluorescerende kulstofprikker hjælper kampen mod sygdomSkematisk diagram af forberedelses- og responsmekanismen for NCDer. Kredit:Wei Chen Evnen til pålideligt og præcist at detektere niveauer af iodidion og curcumin er afgørende inden for fødevare- o
Hvordan nitrogen-doterede fluorescerende kulstofprikker hjælper kampen mod sygdomSkematisk diagram af forberedelses- og responsmekanismen for NCDer. Kredit:Wei Chen Evnen til pålideligt og præcist at detektere niveauer af iodidion og curcumin er afgørende inden for fødevare- o -
 COVID-åndedrætstest-kan det være det næste? Forskning siger jaFra venstre:University of Canterbury forskere postdoktor Dr. Fiona Given og lektor Deborah Crittenden ved Biomolecular Interaction Center. Kredit:University of Canterbury Enhver, der har oplevet e
COVID-åndedrætstest-kan det være det næste? Forskning siger jaFra venstre:University of Canterbury forskere postdoktor Dr. Fiona Given og lektor Deborah Crittenden ved Biomolecular Interaction Center. Kredit:University of Canterbury Enhver, der har oplevet e
- Undersøgelser undersøger marine hedebølger, skiftende havstrømme
- Hvem fandt varmeeffekt af elektrisk strøm?
- Hvordan sker fusion i solen?
- Hvor mange valenselektroner ønsker brom?
- Forskere finder, at de globale metanudledninger fra havet domineres af lavt kystvand
- Hvad er den empiriske formel for en forbindelse, der 40 procent svovl og 60 ilt efter vægt?


