Hvor mange milliliter saltsyre er nødvendige for at reagere med 56,5 g zinksulfid?
1. Skriv den afbalancerede kemiske ligning
Reaktionen mellem zinksulfid (ZnS) og saltsyre (HCI) producerer zinkchlorid (ZnCl₂) og hydrogensulfidgas (H₂S):
Zns (S) + 2HCl (aq) → Zncl₂ (aq) + H₂s (g)
2. Konverter gram af ZnS til mol
* Find den molære masse af Zns:(65,38 g/mol Zn) + (32,06 g/mol S) =97,44 g/mol
* Opdel massen af Zns med dens molære masse:56,5 g / 97,44 g / mol =0,580 mol ZnS
3. Brug molforholdet til at finde mol af HCL
* Den afbalancerede ligning viser et forhold på 1:2 mol mellem ZnS og HCI.
* Multiplicer molen af ZnS med 2 for at finde de nødvendige mol af HCl:0,580 mol Zns * 2 =1,16 mol HCl
4. Antag en koncentration for HCL
* Du skal kende koncentrationen af HCL -løsningen for at beregne volumen. Lad os antage, at vi har en 1,0 m HCL -løsning (hvilket betyder 1 mol HCI pr. Liter opløsning).
5. Beregn mængden af HCL
* Brug molariteten og molen af HCL til at finde lydstyrken:
Volumen =mol / molaritet =1,16 mol / 1,0 mol / l =1,16 l
* Konverter liter til milliliter:1,16 L * 1000 ml/l =1160 ml
Derfor har du brug for ca. 1160 ml på 1,0 m saltsyre for at reagere med 56,5 gram zinksulfid.
Vigtig note: Denne beregning antager fuldstændig reaktion. I virkeligheden kan faktorer som reaktionsbetingelser og renhed af reaktanter påvirke det faktiske krævede volumen.
 Varme artikler
Varme artikler
-
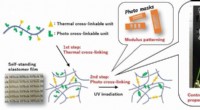 Udvikling af film med justerbar forlængelse og brud til forskellige formålDobbelt-termisk og foto-tværbinding af polymerkæder til syntese af alsidig elastomer. Forskere fra Japan formåede at udvikle en elastomerfilm med justerbar elasticitet ved hjælp af en to-trins termisk
Udvikling af film med justerbar forlængelse og brud til forskellige formålDobbelt-termisk og foto-tværbinding af polymerkæder til syntese af alsidig elastomer. Forskere fra Japan formåede at udvikle en elastomerfilm med justerbar elasticitet ved hjælp af en to-trins termisk -
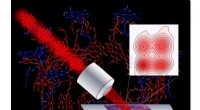 Forskere udvikler mikroskop til at spore lysenergistrøm i fotosyntetiske cellerAnvender en række ultrakorte laserpulser, et nyt mikroskop afslører indviklede detaljer, der styrer fotosyntetiske processer i lilla bakterier. Kredit:Vivek Tiwari, Yassel Acosta og Jennifer Ogilvie
Forskere udvikler mikroskop til at spore lysenergistrøm i fotosyntetiske cellerAnvender en række ultrakorte laserpulser, et nyt mikroskop afslører indviklede detaljer, der styrer fotosyntetiske processer i lilla bakterier. Kredit:Vivek Tiwari, Yassel Acosta og Jennifer Ogilvie -
 Solceller:Kortlægning af landskabet for cæsiumbaserede uorganiske halogenidperovskitterAlle prøver er blevet udskrevet i HySPRINT-laboratoriet på HZB. Kredit:H. Näsström/HZB Forskere ved HZB har trykt og undersøgt forskellige sammensætninger af cæsiumbaserede halogenidperovskitter (
Solceller:Kortlægning af landskabet for cæsiumbaserede uorganiske halogenidperovskitterAlle prøver er blevet udskrevet i HySPRINT-laboratoriet på HZB. Kredit:H. Näsström/HZB Forskere ved HZB har trykt og undersøgt forskellige sammensætninger af cæsiumbaserede halogenidperovskitter ( -
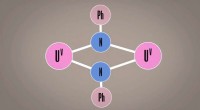 Uran skal erstatte plastik? Kemiens gennembrud kan bane vejen for nye materialerUran kan udføre reaktioner, som ingen tidligere troede var mulige, som kan ændre den måde, industrien fremstiller bulkkemikalier på, polymerer, og forløberne for nye lægemidler og plastik, ifølge nye
Uran skal erstatte plastik? Kemiens gennembrud kan bane vejen for nye materialerUran kan udføre reaktioner, som ingen tidligere troede var mulige, som kan ændre den måde, industrien fremstiller bulkkemikalier på, polymerer, og forløberne for nye lægemidler og plastik, ifølge nye
- De 20 bedste steder at tackle amerikansk kvælstofforurening på gården
- Ryanair ramt af investoroprør over lederlønninger
- Forskning afdækker manglende fysik i eksplosive hotspots
- Hvad er det maksimale antal spdf i kemi?
- Hvordan spiller videnskab en rolle i dit daglige liv?
- Gamle afføring afslører parasitter i 8, 000 år gamle landsby Çatalhöyük


