Er eksoterme reaktioner nedbrydning, eller synteser de reaktioner?
* eksotermiske reaktioner er reaktioner, hvor varme frigøres til omgivelserne. Dette betyder, at produkterne har lavere energi end reaktanterne.
* nedbrydning af reaktioner Opdel et større molekyle i mindre. Dette kan være eksoterm, hvis de obligationer, der brydes, frigiver mere energi end krævet for at bryde dem.
* Synteseaktioner Kombiner mindre molekyler i en større. Dette kan være eksoterm, hvis de dannede bindinger frigiver mere energi end krævet for at bryde bindingerne i reaktanterne.
Eksempler:
* eksotermisk nedbrydning: Forbrændingen af methan (CH4) bryder den ned i kuldioxid (CO2) og vand (H2O), der frigiver varme.
* eksotermisk syntese: Reaktionen af natrium (Na) med chlor (CL2) til dannelse af natriumchlorid (NaCl) frigiver varme.
Kort sagt bestemmer typen af reaktion (nedbrydning eller syntese) ikke, om den er eksoterm eller endotermisk. Energiændringen under obligationsbrud og dannelse bestemmer, om varme frigøres eller absorberes.
 Varme artikler
Varme artikler
-
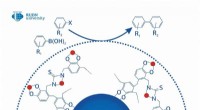 En grøn katalysator for farmaceutisk og industriel kemiMange produktionsfaciliteter (f.eks. plastproducenter, medicinalfirmaer, og andre) bruge nanokatalysatorer, der indeholder palladium - en dyr komponent, der ikke er bæredygtigt produceret. En kemiker
En grøn katalysator for farmaceutisk og industriel kemiMange produktionsfaciliteter (f.eks. plastproducenter, medicinalfirmaer, og andre) bruge nanokatalysatorer, der indeholder palladium - en dyr komponent, der ikke er bæredygtigt produceret. En kemiker -
 At omdanne menneskeligt affald til plastik, næringsstoffer kan hjælpe med lange rumrejserAstronauter kunne en dag drage fordel af at genbruge menneskeligt affald på lange rumrejser (fotoillustration). Kredit:American Chemical Society Forestil dig, at du er på vej til Mars, og du miste
At omdanne menneskeligt affald til plastik, næringsstoffer kan hjælpe med lange rumrejserAstronauter kunne en dag drage fordel af at genbruge menneskeligt affald på lange rumrejser (fotoillustration). Kredit:American Chemical Society Forestil dig, at du er på vej til Mars, og du miste -
 Generering af strøm fra forurenet luftDen nye enhed må kun udsættes for lys for at rense luft og generere strøm. Kredit:UAntwerpen og KU Leuven Forskere fra University of Antwerpen og KU Leuven (University of Leuven), Belgien, har udv
Generering af strøm fra forurenet luftDen nye enhed må kun udsættes for lys for at rense luft og generere strøm. Kredit:UAntwerpen og KU Leuven Forskere fra University of Antwerpen og KU Leuven (University of Leuven), Belgien, har udv -
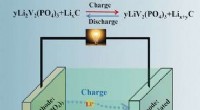 Højhastigheds- og langtidsholdbart lithium-ion-batteri med forbedret ydeevne ved lav temperatur gen…Kredit:Wiley Når det er koldt om vinteren, biler har en tendens til at have startproblemer. Dette er ikke meget bedre med elbiler, som uundgåeligt mister kapaciteten af deres genopladelige lithi
Højhastigheds- og langtidsholdbart lithium-ion-batteri med forbedret ydeevne ved lav temperatur gen…Kredit:Wiley Når det er koldt om vinteren, biler har en tendens til at have startproblemer. Dette er ikke meget bedre med elbiler, som uundgåeligt mister kapaciteten af deres genopladelige lithi
- Hvad er virkningerne af magt, når de udøves på et objekt?
- Kan digitale betalinger hjælpe lande med at tilpasse sig klimaforandringerne?
- Ozonnedbrydning driver klimaændringer på den sydlige halvkugle
- Brug af spejle til at forbedre kvaliteten af lyspartikler
- Menneskelig indflydelse på jordens atmosfære
- Hvad er sammensætningen af jernchlorid?


