Hvorfor er jod mere opløselig i parafin end vand?
* jod (i₂) er et ikke -polært molekyle: Det har en symmetrisk struktur med en jævn fordeling af elektroner, hvilket betyder, at den ikke har en signifikant positiv eller negativ ende.
* parafin er et ikke -polært opløsningsmiddel: Det er primært sammensat af kulbrinter, som er ikke -polære molekyler.
* vand er et polært opløsningsmiddel: Vandmolekyler har en bøjet form med en lidt positiv ende (brint) og en lidt negativ ende (ilt), hvilket gør den polær.
hvorfor "som opløser som" værker:
* ikke -polære molekyler interagerer primært gennem svage van der Waals Forces: Disse kræfter stammer fra midlertidige udsving i elektronfordeling. Ikke -polære opløsningsmidler som parafin kan let interagere med andre ikke -polære molekyler som jod gennem disse kræfter.
* polære molekyler interagerer gennem stærkere dipol-dipol kræfter og brintbindinger: Disse kræfter stammer fra permanent ladningsadskillelse inden for molekylet. Polære opløsningsmidler som vand har en tendens til at favorisere interaktion med andre polære molekyler.
Derfor:
* Jod, der er ikke -polær, opløses let i den ikke -polære parafin, hvor det kan interagere gennem svage van der Waals -styrker.
* Vand, der er polær, kan ikke effektivt interagere med det ikke -polære iodmolekyle. Som et resultat har jod begrænset opløselighed i vand.
Kortfattet: Forskellen i polaritet mellem jod og opløsningsmidler er hovedårsagen til dens større opløselighed i parafin.
Sidste artikelForskere, der studerer, hvordan stoffer reagerer for at påvirke miljøet?
Næste artikelHvorfor opløses iod let i CCL4?
 Varme artikler
Varme artikler
-
 Undersøgelse afslører en unik måde for cellemigration på bløde viskoelastiske overfladerKredit:CC0 Public Domain Inde i din krop, cellebevægelse spiller en afgørende rolle i mange væsentlige biologiske processer, herunder sårheling, immunreaktioner og den potentielle spredning af kræ
Undersøgelse afslører en unik måde for cellemigration på bløde viskoelastiske overfladerKredit:CC0 Public Domain Inde i din krop, cellebevægelse spiller en afgørende rolle i mange væsentlige biologiske processer, herunder sårheling, immunreaktioner og den potentielle spredning af kræ -
 Forskere udvikler lovende ny type polymerLyse farver:SPPV -polymerer har mange vigtige teknologiske anvendelser. Kredit:TU Wien Organiske polymerer bruges i solceller, sensorer, LEDer og i mange andre enheder. En specifik type polymer, S
Forskere udvikler lovende ny type polymerLyse farver:SPPV -polymerer har mange vigtige teknologiske anvendelser. Kredit:TU Wien Organiske polymerer bruges i solceller, sensorer, LEDer og i mange andre enheder. En specifik type polymer, S -
 Wafer-skala flerlags fremstilling af silke fibroin-baseret mikroelektronikFigur 1. Forsiden af ACS anvendte materialer og grænseflader . Kredit: ACS anvendte materialer og grænseflader Et KAIST-forskerhold udviklede en ny fremstillingsmetode til flerlagsbehandling af
Wafer-skala flerlags fremstilling af silke fibroin-baseret mikroelektronikFigur 1. Forsiden af ACS anvendte materialer og grænseflader . Kredit: ACS anvendte materialer og grænseflader Et KAIST-forskerhold udviklede en ny fremstillingsmetode til flerlagsbehandling af -
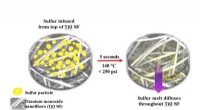 En stabiliserende påvirkning muliggør udvikling af lithium-svovlbatterierHot-press proceduren, udviklet hos Drexel, smelter svovl ind i nanofibermåtterne i et let tryksat, 140-graders celsius miljø - eliminerer behovet for tidskrævende behandling, der bruger en blanding af
En stabiliserende påvirkning muliggør udvikling af lithium-svovlbatterierHot-press proceduren, udviklet hos Drexel, smelter svovl ind i nanofibermåtterne i et let tryksat, 140-graders celsius miljø - eliminerer behovet for tidskrævende behandling, der bruger en blanding af
- Klimaændringer kan gøre det dyrere at låne penge for stater og byer
- Scanning af tunnelmikroskopi afslører uventet optisk fononeffekt
- Hvordan skifter du en 9 -hastighed?
- Hvorfor har den større masse sin inerti?
- Hvad sker der med opløsningens farve, når kobberchlorid nedbrydes?
- Anti-tyngdekraft:Hvordan en båd kan flyde på hovedet


