Beregn hydroniumionkoncentrationen i en vandig opløsning, der indeholder 2,50 x 10-4 M hydroxidion?
forståelse af forholdet
I enhver vandig opløsning er produktet af hydroniumionkoncentrationen ([H3O+]) og hydroxidionkoncentrationen ([OH-]) en konstant værdi kendt som ionproduktet af vand (KW).
* KW =[H3O+] [OH-] =1,0 x 10^-14 ved 25 ° C
Beregning
1. Omarranger ligningen: For at løse for [H3O+] skal du dele begge sider af ligningen med [OH-]:
[H3O+] =KW / [OH-]
2. erstatte værdierne:
[H3O+] =(1,0 x 10^-14) / (2,50 x 10^-4)
3. Beregn:
[H3O+] =4,0 x 10^-11 m
Svar:
Hydroniumionkoncentrationen i opløsningen er 4,0 x 10^-11 m .
Sidste artikelHvad er ladningen på en kobberchloridion?
Næste artikelHvorfor skal sølvchlorid beskyttes mod lys?
 Varme artikler
Varme artikler
-
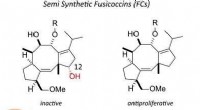 Redigeret plantebaseret toksin besidder antitumoregenskaberFusicoccin, et fytotoksin, blev omdannet til en række antiproliferative midler til tumorceller ved at fjerne 12-hydroxylgruppen. Disse forbindelser blev vist at opregulere interaktion mellem 1433 og e
Redigeret plantebaseret toksin besidder antitumoregenskaberFusicoccin, et fytotoksin, blev omdannet til en række antiproliferative midler til tumorceller ved at fjerne 12-hydroxylgruppen. Disse forbindelser blev vist at opregulere interaktion mellem 1433 og e -
 Reducerer smeltede salte ætsende virkningDette diagram viser, hvordan et koncentrerende solvarmeanlæg kunne bruge smeltede salte til at lagre solenergi, som senere kunne bruges til at generere elektricitet. Kredit:Jaimee Janiga/ORNL, U.S. De
Reducerer smeltede salte ætsende virkningDette diagram viser, hvordan et koncentrerende solvarmeanlæg kunne bruge smeltede salte til at lagre solenergi, som senere kunne bruges til at generere elektricitet. Kredit:Jaimee Janiga/ORNL, U.S. De -
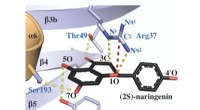 Nøgleenzym fundet i planter kan styre udviklingen af medicin og andre produkterProtein røntgenkrystalstrukturen af chalcone isomerase, kompleksbundet med et produktmolekyle kaldet (2S)-naringenin, afslører, hvordan det aktive sted arginin (mærket som Arg 37) letter katalyse af
Nøgleenzym fundet i planter kan styre udviklingen af medicin og andre produkterProtein røntgenkrystalstrukturen af chalcone isomerase, kompleksbundet med et produktmolekyle kaldet (2S)-naringenin, afslører, hvordan det aktive sted arginin (mærket som Arg 37) letter katalyse af -
 Team sikrer stabilitet af afsaltningsprocessen med magnesiumForsker Hye-Won Kim tilføjer magnesium til havvand for at hæmme tilsmudsning af afsaltningsmembraner. Kredit:Korea Institute of Science and Technology (KIST) Et koreansk forskerhold fandt en metod
Team sikrer stabilitet af afsaltningsprocessen med magnesiumForsker Hye-Won Kim tilføjer magnesium til havvand for at hæmme tilsmudsning af afsaltningsmembraner. Kredit:Korea Institute of Science and Technology (KIST) Et koreansk forskerhold fandt en metod
- Tegn på tidligere mega-skælv i Californien viser fare for den store på San Andreas-fejl
- NASA analyserer den nyeste subtropiske depression i Atlanterhavet
- Hvordan konverteres kemisk energi til mekanisk energi?
- 'Sådan skal et sundt fællesskab være':Hvordan musik i ungdomsfængsling kan skabe nye fremtider
- Shopify slutter sig til nonprofitorganisationen bag Facebooks Libra-valuta
- Hvad er en stor luftmasse, der har de samme egenskaber som overflade, som den udvikler?


