Hvad er ladningen på en kobberchloridion?
* kobber (CU) kan have flere afgifter: Det kan være +1 (Cu +) eller +2 (Cu2 +).
* chlorid (CL) har altid en -1 -afgift: Cl-
For at danne en neutral forbindelse skal afgifterne afbalancere. Så afhængigt af kobberionen:
* cucl (kobber (i) chlorid): Cu + + cl- =0
* cucl2 (kobber (II) chlorid): Cu2 + + 2cl- =0
Derfor afhænger ladningen på kobberchloridion af den specifikke form for kobberchlorid.
 Varme artikler
Varme artikler
-
 Udforskning af den neurologiske påvirkning af luftforureningKredit:CC0 Public Domain Luftforurening er blevet en kendsgerning i det moderne liv, med et flertal af den globale befolkning, der står over for kronisk eksponering. Selvom virkningen af at indå
Udforskning af den neurologiske påvirkning af luftforureningKredit:CC0 Public Domain Luftforurening er blevet en kendsgerning i det moderne liv, med et flertal af den globale befolkning, der står over for kronisk eksponering. Selvom virkningen af at indå -
 Forskere udfolder hemmelig stabilitet af bøjede sugerørUMass Amherst materialeforskere, med kolleger hos Virginia Tech, mener, at deres er den første undersøgelse, der undersøger, hvordan og hvorfor strukturer som bøjelige sugerør og sammenklappelige hund
Forskere udfolder hemmelig stabilitet af bøjede sugerørUMass Amherst materialeforskere, med kolleger hos Virginia Tech, mener, at deres er den første undersøgelse, der undersøger, hvordan og hvorfor strukturer som bøjelige sugerør og sammenklappelige hund -
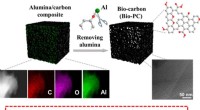 Grænseflade-induceret fremstilling af porøst kulstof med forbedrede iboende aktive stederUnder ikke-oxidationsbetingelser blev in-situ dannet aluminiumoxid/carbon-grænseflade udviklet som en vugge til generering af tilgængelige aktive steder. Det kan også justere den porøse struktur af re
Grænseflade-induceret fremstilling af porøst kulstof med forbedrede iboende aktive stederUnder ikke-oxidationsbetingelser blev in-situ dannet aluminiumoxid/carbon-grænseflade udviklet som en vugge til generering af tilgængelige aktive steder. Det kan også justere den porøse struktur af re -
 Forskere rapporterer kraftig ionoverførsel i ladet vdW-klynge for første gangSammenfaldskortet viser tidspunktet for flyvninger mellem det første og det andet fragmention, der ankommer til detektoren. Kredit:IMP Siden opdagelsen af den dobbelte helixform af DNA og hypote
Forskere rapporterer kraftig ionoverførsel i ladet vdW-klynge for første gangSammenfaldskortet viser tidspunktet for flyvninger mellem det første og det andet fragmention, der ankommer til detektoren. Kredit:IMP Siden opdagelsen af den dobbelte helixform af DNA og hypote
- Hvordan kan jeg skabe en drømmende atmosfære i mit værelse ved at bruge hvidt lys, de mørke stje…
- Hvorfor landede Apollo 11 på månen?
- FORKLARER:4 vil kredse om Jorden på 1. SpaceX privatflyvning
- Elever, der er født tidligere på året, har færre venner
- Hvad er et eksempel på sporfossil?
- Så meget pres som Uranus-kernen:Den første forskning og undersøgelse af materialesyntese i terapa…


