Hvad sker der med en opløsning, når metaloxid opløses i vand?
1. Den kemiske reaktion:
* Metaloxider har generelt grundlæggende karakter. Når de opløses i vand, reagerer de med vandmolekyler for at danne metalhydroxider og frigive hydroxidioner (OH⁻) i opløsningen.
Eksempel:
* Natriumoxid (Na₂o) reagerer med vand til dannelse af natriumhydroxid (NaOH):
Na₂o (S) + H₂O (L) → 2NAOH (AQ)
2. Dannelse af metalhydroxid:
* Det dannede metalhydroxid er normalt en base. Styrken af basen afhænger af det involverede metal.
3. PH -ændring:
* Frigivelsen af hydroxidioner i opløsningen øger sin pH, hvilket gør den mere alkalisk (grundlæggende).
4. Andre faktorer:
* opløselighed: Ikke alle metaloxider er opløselige i vand. Nogle, som jernoxid (Fe₂o₃), er praktisk talt uopløselige. Opløseligheden af et metaloxid afhænger af metalens position i den periodiske tabel og dens oxidationstilstand.
* Dannelse af hydrater: Nogle metaloxider kan reagere med vand for at danne hydrater. Hydrater er forbindelser, hvor vandmolekyler er inkorporeret i krystalstrukturen af metaloxidet.
* komplekse reaktioner: I nogle tilfælde kan reaktionen mellem et metaloxid og vand være mere kompleks, hvilket fører til dannelse af forskellige produkter, såsom hydroxider, oxyhydroxider eller endda salte.
I resuméet, når et metaloxid opløses i vand, danner det et metalhydroxid, øger opløsningens pH og kan potentielt danne hydrater eller andre produkter afhængigt af den specifikke metal og dets oxidationstilstand.
Sidste artikelEr gruppe 7A -elementer de alkaliske jordmetaller?
Næste artikelEr acetylen C2H2 en forbindelse eller et element?
 Varme artikler
Varme artikler
-
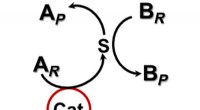 Accelererer kemiske reaktioner uden direkte kontakt med en katalysatorEt berøringsfrit katalytisk system. Kredit: Videnskabens fremskridt (2020). DOI:10.1126/sciadv.aax6637 Et forskerhold fra Northwestern University har afsløret en ny tilgang til at udføre kemiske
Accelererer kemiske reaktioner uden direkte kontakt med en katalysatorEt berøringsfrit katalytisk system. Kredit: Videnskabens fremskridt (2020). DOI:10.1126/sciadv.aax6637 Et forskerhold fra Northwestern University har afsløret en ny tilgang til at udføre kemiske -
 Forskere fandt et alternativ til vandchloreringSpecialister i (SPbPU), udviklet et unikt udstyr til kompleks vandrensning. Kredit:Peter den Store St. Petersborg Polytechnic University Forskere ved Peter den Store St.Petersburg Polytechnic Univ
Forskere fandt et alternativ til vandchloreringSpecialister i (SPbPU), udviklet et unikt udstyr til kompleks vandrensning. Kredit:Peter den Store St. Petersborg Polytechnic University Forskere ved Peter den Store St.Petersburg Polytechnic Univ -
 Ny forskning kan give bedre mad og hurtigere analyse af blodprøverAnne Bech Risum og Rasmus Bro ved siden af gaskromatografen på Institut for Fødevarevidenskab, ved Københavns Universitet (UCPH FOOD) i Danmark. Kredit:Morten Vormsborg Christiansen Gaskromatogr
Ny forskning kan give bedre mad og hurtigere analyse af blodprøverAnne Bech Risum og Rasmus Bro ved siden af gaskromatografen på Institut for Fødevarevidenskab, ved Københavns Universitet (UCPH FOOD) i Danmark. Kredit:Morten Vormsborg Christiansen Gaskromatogr -
 Klarhed nødvendig i klassificeringssystemer til forarbejdede fødevarerKredit:Pixabay/CC0 Public Domain Nuværende fødevareklassifikationssystemer for forarbejdede fødevarer mangler konsistens og konsensus, der ofte fører til forvirring og debat, selv blandt forskere,
Klarhed nødvendig i klassificeringssystemer til forarbejdede fødevarerKredit:Pixabay/CC0 Public Domain Nuværende fødevareklassifikationssystemer for forarbejdede fødevarer mangler konsistens og konsensus, der ofte fører til forvirring og debat, selv blandt forskere,


