Hvad er den oprindelige årsag til dissocieringsvandmolekyler i brint- og hydroxidioner?
Her er hvorfor:
* vandets polaritet: Vandmolekyler er bøjet, hvor iltatomet er mere elektronegativt end hydrogenatomerne. Dette skaber en delvis negativ ladning på iltatomet og delvis positive ladninger på hydrogenatomerne.
* Hydrogenbinding: På grund af denne polaritet kan vandmolekyler danne hydrogenbindinger med hinanden, hvor den positive brintende af et molekyle tiltrækkes af den negative ilt ende af en anden.
* dissociation: Den stærke attraktion mellem vandmolekyler gennem hydrogenbinding skaber en svag, midlertidig attraktion mellem iltatomet i et vandmolekyle og hydrogenatomet af et andet. Denne attraktion kan være så stærk, at den lejlighedsvis bryder den kovalente binding mellem hydrogenatomet og iltatomet, hvilket resulterer i dannelsen af en hydrogenion (H+) og et hydroxidion (OH-):
H₂O → H + + OH-
Vigtig note: Denne proces er en ligevægtsreaktion, hvilket betyder, at den sker kontinuerligt i begge retninger. Vandmolekyler dannes konstant og bryder fra hinanden, men koncentrationen af H+ og OH-ioner forbliver relativt lav i rent vand (ca. 10 ⁻⁷ m hver).
Fortæl mig, hvis du gerne vil udforske mere om Water's egenskaber eller begrebet PH!
Sidste artikelHvor mange atomer af svovl er der i 3 g svovl?
Næste artikelHvad er den kemiske formel for Fe Po?
 Varme artikler
Varme artikler
-
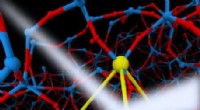 Hvad forårsager den top? Besvarelse af et langvarigt spørgsmål om kovalente væskerRøntgenspredning (hvid beem) billede af lokal tetraedrisk orden dannet af Si-atomer (store gule partikler) i flydende silica (Si-atomer er store partikler og O-atomer er små partikler) ved simulering.
Hvad forårsager den top? Besvarelse af et langvarigt spørgsmål om kovalente væskerRøntgenspredning (hvid beem) billede af lokal tetraedrisk orden dannet af Si-atomer (store gule partikler) i flydende silica (Si-atomer er store partikler og O-atomer er små partikler) ved simulering. -
 Brug af skovens naturlige evne til at bøje sig ved tørring for at skabe buede strukturerUrbach-tårnet, en 14 m høj bygningsdemonstrator med høj krumning CLT-komponenter fremstillet ved hjælp af selvformende fremstillingsteknologi. Kredit:ICD/ITKE Universitetet i Stuttgart Et team af
Brug af skovens naturlige evne til at bøje sig ved tørring for at skabe buede strukturerUrbach-tårnet, en 14 m høj bygningsdemonstrator med høj krumning CLT-komponenter fremstillet ved hjælp af selvformende fremstillingsteknologi. Kredit:ICD/ITKE Universitetet i Stuttgart Et team af -
 Forskere forbereder nyt lavtsmeltende, nitrogenholdigt, stannochlorophosphatglasSn-P-O-Cl-N glas fremstillet ved forskellige temperaturer. Kredit:SIOM Forskere fra Shanghai Institute of Optics and Fine Mechanics (SIOM) fra det kinesiske videnskabsakademi (CAS) har forberedt et
Forskere forbereder nyt lavtsmeltende, nitrogenholdigt, stannochlorophosphatglasSn-P-O-Cl-N glas fremstillet ved forskellige temperaturer. Kredit:SIOM Forskere fra Shanghai Institute of Optics and Fine Mechanics (SIOM) fra det kinesiske videnskabsakademi (CAS) har forberedt et -
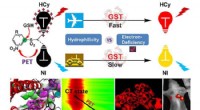 Fluorophores elektronmangel påvirker genkendelsesevnen af nær-infrarøde fluorescerende proberFluorophores elektronmangel kan påvirke genkendelsesydelsen af nær-infrarøde fluorescerende prober. Kredit:ZHANG Xuexiang Glutathion S-transferaser (GST) er et af de vigtigste fase II afgiftning
Fluorophores elektronmangel påvirker genkendelsesevnen af nær-infrarøde fluorescerende proberFluorophores elektronmangel kan påvirke genkendelsesydelsen af nær-infrarøde fluorescerende prober. Kredit:ZHANG Xuexiang Glutathion S-transferaser (GST) er et af de vigtigste fase II afgiftning
- Brugt SpaceX booster sæt til historisk første tilbageflugt er testfyret i Texas
- Sammenligning af bregner og blomstrende planter
- Transformationel innovation er nødvendig for at nå globale skogenopretningsmål
- Sådan beregnes antallet af atomer, der er angivet i gram- og atommasseenhederne
- Hvad anvendelser af natriumhydroxid i biuret -test?
- Caribisk bosættelse begyndte i de større Antiller, siger forskere


