Hvilken har et højere kogepunkt CH3CH3 eller CH3NH2?
* Hydrogenbinding: Methylamin (CH3NH2) kan danne hydrogenbindinger. Nitrogenatomet i amingruppen (NH2) har et ensomt par elektroner, der kan danne en hydrogenbinding med et hydrogenatom på et andet molekyle. Denne stærke intermolekylære interaktion kræver mere energi til at bryde, hvilket fører til et højere kogepunkt.
* van der Waals Forces: Ethan (CH3CH3) udviser kun svagere van der Waals -styrker (London -spredningskræfter) på grund af dens ikke -polære karakter. Disse kræfter er svagere end brintbindinger.
Kortfattet: Methylaminens evne til at danne hydrogenbindinger, en stærkere intermolekylær kraft sammenlignet med van der Waals -kræfter i ethan, resulterer i et højere kogepunkt for methylamin.
 Varme artikler
Varme artikler
-
 Kan dette invasive eksotiske skadedyr lave bedre materialer til industri og medicin?Selvom det var uappetitligt i dette lab -skud, disse skabninger bruges allerede til mange andre formål, herunder som ingrediens i det asiatiske køkken. Kredit:Johan Foster Forskere ved National In
Kan dette invasive eksotiske skadedyr lave bedre materialer til industri og medicin?Selvom det var uappetitligt i dette lab -skud, disse skabninger bruges allerede til mange andre formål, herunder som ingrediens i det asiatiske køkken. Kredit:Johan Foster Forskere ved National In -
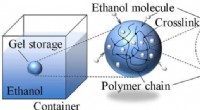 Forskere viser, hvordan man opbevarer flydende brændstoffer i polymere geler for at forhindre ekspl…Forskere fra SIT Japan viste i en ny undersøgelse, at kemisk tværbundne polymere gel-netværk kan fange meget flygtige flydende brændstofmolekyler, såsom ethanol, gennem fysiske interaktioner og derved
Forskere viser, hvordan man opbevarer flydende brændstoffer i polymere geler for at forhindre ekspl…Forskere fra SIT Japan viste i en ny undersøgelse, at kemisk tværbundne polymere gel-netværk kan fange meget flygtige flydende brændstofmolekyler, såsom ethanol, gennem fysiske interaktioner og derved -
 En ny teknik til at slette enkelte atomer kan fremskynde molekyledesignAsst. Prof. Mark Levin (til venstre) og ph.d. studerende Jisoo Woo på arbejde i laboratoriet på University of Chicago. Kredit:Jason Thome Hver gang der annonceres et nyt kræftlægemiddel, repræsente
En ny teknik til at slette enkelte atomer kan fremskynde molekyledesignAsst. Prof. Mark Levin (til venstre) og ph.d. studerende Jisoo Woo på arbejde i laboratoriet på University of Chicago. Kredit:Jason Thome Hver gang der annonceres et nyt kræftlægemiddel, repræsente -
 Video:Kemien ved madlavningKredit:The American Chemical Society Voldsomme køkkengadgets som langsomme komfurer og trykkogere fylder meget. Mange mennesker spekulerer måske på, om det er umagen værd at eje så mange glorifice
Video:Kemien ved madlavningKredit:The American Chemical Society Voldsomme køkkengadgets som langsomme komfurer og trykkogere fylder meget. Mange mennesker spekulerer måske på, om det er umagen værd at eje så mange glorifice
- Sætter spørgsmålstegn ved sammenhængen mellem forurening af magnetitpartikler og Alzheimers sygd…
- Forbliver solfusionshastigheden stabil eller varierer meget?
- Hvad er et objekt eller materiale, der kan overføre energi til andre objekter?
- Dækafgrøderødder er en vigtig nøgle til at forstå økosystemtjenester
- Hvad har osmose og diffusion til fælles?
- Droner bruges til at lokalisere farlige, afbrudte olieboringer


