Hvilken effekt har tilsætning af salt på smeltepunktet for is?
* frysningspunktdepression: Salt opløses i vand og danner ioner (ladede partikler). Disse ioner forstyrrer det regelmæssige arrangement af vandmolekyler i iskrystallstrukturen. Denne forstyrrelse gør det sværere for vandmolekylerne at binde sig sammen og forblive solide, hvilket sænker frysestedet (og dermed smeltepunktet) af vandet.
* Kolligativ egenskab: Denne effekt kaldes "frysepunktdepression", og det er en colligative egenskab. Dette betyder, at ændringen i frysepunktet kun afhænger af koncentrationen af opløste partikler, ikke af den specifikke type opløst stof (i dette tilfælde salt).
* Praktisk eksempel: Derfor bruger vi salt på iskolde veje og fortove om vinteren. Salt sænker vandets frysepunkt, så isen smelter selv ved temperaturer under 0 ° C (32 ° F).
Vigtig note: Mængden af salt, der er nødvendig for at sænke frysepunktet, afhænger markant af koncentrationen. En lille mængde salt vil have en minimal effekt.
 Varme artikler
Varme artikler
-
 Undersøgelse afslører ny indsigt i, hvordan hybride perovskit-solceller fungererDenne illustration viser, hvad der sker inde i et hybridt perovskitmateriale i de første par billiontedele af et sekund, efter at det er ramt af simuleret sollys (øverst til venstre). De blå og grønne
Undersøgelse afslører ny indsigt i, hvordan hybride perovskit-solceller fungererDenne illustration viser, hvad der sker inde i et hybridt perovskitmateriale i de første par billiontedele af et sekund, efter at det er ramt af simuleret sollys (øverst til venstre). De blå og grønne -
 Forskning lodder de molekylære byggesten til lysfølsomme materialerKredit:tanleimages/Shutterstock At skabe den næste generation af solceller og sensorer kræver et nøje kig på, hvordan lys interagerer med lysfølsomme materialer. Forskning ved U.S. Department of E
Forskning lodder de molekylære byggesten til lysfølsomme materialerKredit:tanleimages/Shutterstock At skabe den næste generation af solceller og sensorer kræver et nøje kig på, hvordan lys interagerer med lysfølsomme materialer. Forskning ved U.S. Department of E -
 Mine efter guld med en computerDisse billeder viser nogle af de fysiske egenskaber ved nanoporøst guld ved forskellige forstørrelser. Kredit:Texas A&M University Ingeniører fra Texas A&M University og Virginia Tech rapporterer
Mine efter guld med en computerDisse billeder viser nogle af de fysiske egenskaber ved nanoporøst guld ved forskellige forstørrelser. Kredit:Texas A&M University Ingeniører fra Texas A&M University og Virginia Tech rapporterer -
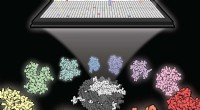 Scanner tusindvis af molekyler mod et uhåndgribeligt kræftmålEn ny undersøgelse udviklede et sæt metoder til at screene tusinder af små molekyler for at finde hæmmere af kræftmålet NSD2. Kredit:Matthew Hall, NCATS Forskere ved National Center for Advancing
Scanner tusindvis af molekyler mod et uhåndgribeligt kræftmålEn ny undersøgelse udviklede et sæt metoder til at screene tusinder af små molekyler for at finde hæmmere af kræftmålet NSD2. Kredit:Matthew Hall, NCATS Forskere ved National Center for Advancing
- Har solen en større masse end Jorden?
- Ny forskning giver fingerpeg om, hvordan kontinenter blev dannet tidligt i jordens historie (m/ vide…
- Hvad er den hastighed, hvormed strålende varme i rummet?
- Hvad er ikke egenskab for et rent stof?
- Hvad er forskellen mellem alluvial og rød jord?
- Hvor lang er en gennemsnitlig solmåned ne tolvtedel af et år?


