Hvad er den kemiske reaktion af Cucl2 og aluminium?
3Cucl₂ (aq) + 2al (s) → 2Alcl₃ (aq) + 3Cu (s)
Forklaring:
* reaktanter:
* Cucl₂ (kobber (II) chlorid) er en vandig opløsning, hvilket betyder, at den er opløst i vand.
* Al (aluminium) er et solidt metal.
* Produkter:
* ALCL₃ (aluminiumchlorid) er en vandig opløsning.
* Cu (kobber) er et solidt metal.
Hvad sker der:
* Aluminium er mere reaktiv end kobber. Dette betyder, at det har en stærkere tendens til at miste elektroner og danne positive ioner.
* Når aluminium kommer i kontakt med kobber (II) -chlorid, fortrænger aluminiumatomerne kobberioner fra opløsningen.
* Aluminium danner aluminiumchlorid (ALCL₃), der opløses i vand.
* Kobbermetal (CU) deponeres som et fast stof.
Observationer:
* Du vil se en rødlig-brun fast (kobber), der dannes på overfladen af aluminiumet.
* Opløsningen ændrer farve, når kobber (II) chlorid forbruges.
Vigtige noter:
* Denne reaktion er eksoterm, hvilket betyder, at den frigiver varme.
* Reaktionen kan være ret kraftig, især hvis aluminiumet er i pulveriseret form.
* Denne reaktion bruges i nogle applikationer til at rense kobber.
Fortæl mig, hvis du gerne vil udforske mere om nogen af disse punkter!
 Varme artikler
Varme artikler
-
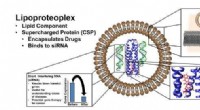 Forskere skaber biomateriale, der leverer både et kraftfuldt lægemiddel og gendæmpereLipoproteoplex bruger en lipid-beholder til transfektion - transport af materiale forbi en cellemembran - og en proteinkapsel, der er nem at fremstille, der kan binde både små molekyle kemoterapeutisk
Forskere skaber biomateriale, der leverer både et kraftfuldt lægemiddel og gendæmpereLipoproteoplex bruger en lipid-beholder til transfektion - transport af materiale forbi en cellemembran - og en proteinkapsel, der er nem at fremstille, der kan binde både små molekyle kemoterapeutisk -
 Nye fotoniske flydende krystaller kan føre til næste generations skærmeEt nærbillede af en blåfaset flydende krystal i mm-størrelse under dannelsesstadiet. Kredit:Khoo Lab, Penn State En ny teknik til at ændre strukturen af flydende krystaller kan føre til udviklin
Nye fotoniske flydende krystaller kan føre til næste generations skærmeEt nærbillede af en blåfaset flydende krystal i mm-størrelse under dannelsesstadiet. Kredit:Khoo Lab, Penn State En ny teknik til at ændre strukturen af flydende krystaller kan føre til udviklin -
 At dreje det periodiske system gennem 180 grader for et nyt perspektivKredit:University of Nottingham Kunne vende det periodiske system på hovedet gøre nogle vigtige aspekter lettere at forstå og begejstre flere for at studere kemi? Dette spørgsmål stilles i en art
At dreje det periodiske system gennem 180 grader for et nyt perspektivKredit:University of Nottingham Kunne vende det periodiske system på hovedet gøre nogle vigtige aspekter lettere at forstå og begejstre flere for at studere kemi? Dette spørgsmål stilles i en art -
 Forskning giver ny indsigt i udviklingen af nervesystemetKredit:CC0 Public Domain Banebrydende forskning har givet en fascinerende frisk indsigt i, hvordan dyrs nervesystem udviklede sig fra enkle strukturer til at blive det komplekse netværk, der trans
Forskning giver ny indsigt i udviklingen af nervesystemetKredit:CC0 Public Domain Banebrydende forskning har givet en fascinerende frisk indsigt i, hvordan dyrs nervesystem udviklede sig fra enkle strukturer til at blive det komplekse netværk, der trans
- Når et metalatom kombineres med ikke-metal, hvordan vil reaktionen?
- Eksponeret kinesisk database viser dybden af overvågningstilstanden
- Hvorfor måler du andre planeter tyngdekraft baseret på tyngdekraften?
- Hvor mange elektroner har natrium i N lig med 2 bane?
- Undersøgelse finder det lige så skræmmende at genoplive gamle venskaber som at få nye
- Hvilken emission af højenergi -stråling eller partikler fra kernen er et atom?


