Hvorfor aluminiumtrifluorid har et højt kogepunkt og derefter siliciumtetrafluorid, hvilket er en gas?
1. Obligationsstyrke:
* alf₃: Aluminium Trifluoridudstillinger ionisk binding . Elektronegativitetsforskellen mellem aluminium og fluor er stor, hvilket fører til overførsel af elektroner og stærke elektrostatiske attraktioner mellem ionerne. Disse stærke ioniske bindinger kræver en betydelig mængde energi for at bryde, hvilket resulterer i et højt kogepunkt.
* sif₄: Silicium tetrafluoridudstillinger kovalent binding . Mens Si-F-bindingen er polær, er molekylet generelt tetrahedral og har en symmetrisk fordeling af elektrondensitet. Dette betyder, at dipolmomenterne annullerer, hvilket fører til svagere intermolekylære kræfter (van der Waals -kræfter) mellem molekyler. Disse svagere kræfter er meget lettere at overvinde, hvilket fører til et lavt kogepunkt.
2. Gitterstruktur:
* alf₃: Aluminiumtrifluorid danner A tredimensionel krystalgitter . Denne stærke, ordnede struktur øger den energi, der er nødvendig for at bryde den faste og fordampende den.
* sif₄: Silicon tetrafluorid er et molekylært fast stof med svage intermolekylære kræfter, der holder molekylerne sammen.
Kortfattet:
* Den ioniske binding i Alf₃ fører til stærke elektrostatiske kræfter, der kræver meget mere energi til at overvinde end de svagere van der Waals -styrker i Sif₄.
* Den tredimensionelle gitterstruktur i Alf₃ styrker bindingerne yderligere og øger den energi, der kræves til fordampning.
Disse faktorer bidrager til den signifikante forskel i kogepunkter mellem Alf₃ og Sif₄.
 Varme artikler
Varme artikler
-
 Tilføjelse af kobber styrker 3-D-printet titanium3D-printede titanium-kobber stænger med titanium pulver og kobber pulver. Kredit:RMIT University Vellykkede forsøg med titanium-kobber-legeringer til 3-D-print kan kickstarte en ny serie af højtyd
Tilføjelse af kobber styrker 3-D-printet titanium3D-printede titanium-kobber stænger med titanium pulver og kobber pulver. Kredit:RMIT University Vellykkede forsøg med titanium-kobber-legeringer til 3-D-print kan kickstarte en ny serie af højtyd -
 En kontrollerbar membran til at trække kuldioxid ud af udstødningsstrømmeneKredit:CC0 Public Domain Et nyt system udviklet af kemiske ingeniører ved MIT kunne give en måde til kontinuerligt at fjerne kuldioxid fra en strøm af affaldsgasser, eller endda fra luften. Nøglek
En kontrollerbar membran til at trække kuldioxid ud af udstødningsstrømmeneKredit:CC0 Public Domain Et nyt system udviklet af kemiske ingeniører ved MIT kunne give en måde til kontinuerligt at fjerne kuldioxid fra en strøm af affaldsgasser, eller endda fra luften. Nøglek -
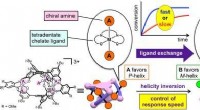 Kiralitetsinversion i et spiralformet molekyle ved kontrollerede hastighederSkema 1 fra avisen. Kredit:Kanazawa University En strategi til at invertere chiraliteten af et metalholdigt spiralformet molekyle, der kontrollerer hastigheden af responsen, er rapporteret i C
Kiralitetsinversion i et spiralformet molekyle ved kontrollerede hastighederSkema 1 fra avisen. Kredit:Kanazawa University En strategi til at invertere chiraliteten af et metalholdigt spiralformet molekyle, der kontrollerer hastigheden af responsen, er rapporteret i C -
 Mod forbedret sårheling:Kemisk syntese af et trefoil faktor peptidUndersøgelser viste, at trefoil-faktor-peptider produceres lokalt for at bekæmpe inflammation og skader i mave-tarmkanalen ved at fremskynde sårheling. Kredit:Universität Wien Den fascinerende fam
Mod forbedret sårheling:Kemisk syntese af et trefoil faktor peptidUndersøgelser viste, at trefoil-faktor-peptider produceres lokalt for at bekæmpe inflammation og skader i mave-tarmkanalen ved at fremskynde sårheling. Kredit:Universität Wien Den fascinerende fam
- Karakteristik af gode buffere
- Hvordan påvirker koldtvandsstrømme kontinenternes vestlige kyster?
- Kan en maskine have 110 procent effektivitet?
- Indsigt i vandgennemstrømning og fiskepassage gennem dæmninger giver muligheder for at opfylde ene…
- Når der opvarmes noget, går den termiske energi fra køligere til varmere genstand eller et objekt…
- Hvilket hav på jorden har det samme volumen som måne?


