Hvad var definitionen af et atom?
Tidlige definitioner:
* Ancient Greek Philosophers (Democritus, Leucippus): Ideen om et atom dukkede først op i det gamle Grækenland. De forestillede sig atomer som udelelige, faste partikler, der udgjorde alle stof.
* John Dalton (1808): Daltons atomteori gav et mere videnskabeligt grundlag for atomet:
* Elementer er sammensat af atomer.
* Alle atomer i et givet element er identiske.
* Atomer af forskellige elementer har forskellige masser.
* Atomer kan ikke oprettes eller ødelægges, kun omarrangeres.
Moderne definitioner:
* J.J. Thomson (1897): Thomsons opdagelse af elektronet førte til blommepudding -modellen, hvor en positivt ladet sfære indeholdt negativt ladede elektroner indlejret i.
* Ernest Rutherford (1911): Rutherfords guldfolieeksperiment viste, at atomet har en tæt, positivt ladet kerne omgivet af et for det meste tomt rum, der indeholder elektroner.
* Niels Bohr (1913): Bohr foreslog, at elektroner optager specifikke energiniveauer omkring kernen og forklarede emissionen af lys fra atomer.
* kvantemekanik: I begyndelsen af det 20. århundrede revolutionerede kvantemekanik forståelsen af atomet. Det afslørede, at elektroner opfører sig som både bølger og partikler, og deres opførsel styres af sandsynligheder snarere end faste kredsløb.
Aktuel definition:
I dag defineres atomet som den mindste enhed i et element, der bevarer de kemiske egenskaber for dette element. Det består af en kerne indeholdende protoner og neutroner og en omgivende sky af elektroner .
Her er en vigtig takeaway:
* Et atom er ikke en lille, solid sfære. Det er et komplekst system med en central kerne omgivet af en probabilistisk sky af elektroner.
Bemærk: Definitionen af et atom udvikler sig stadig, da forskere fortsat udforsker arten af stof ved stadig mindre skalaer.
 Varme artikler
Varme artikler
-
 En forbedret sikkerhedsstandard for bioniske enhederKredit:CC0 Public Domain Anvendte fysikere ved University of Sydney har foreslået nye standarder for måling af fugtlækager i bioniske enheder såsom pacemakere, cochlea -høreimplantater og nethinde
En forbedret sikkerhedsstandard for bioniske enhederKredit:CC0 Public Domain Anvendte fysikere ved University of Sydney har foreslået nye standarder for måling af fugtlækager i bioniske enheder såsom pacemakere, cochlea -høreimplantater og nethinde -
 Mini-protein hurtig designmetode åbner vejen for at skabe en ny klasse af lægemidlerKunstnerindtryk af computerdesignede miniproteinbindere rettet mod influenzahæmagglutinin. Mange binder og neutraliserer effektivt virussen. Kredit:Cognition Studio Seattle, Daniel-Adriano Silva og La
Mini-protein hurtig designmetode åbner vejen for at skabe en ny klasse af lægemidlerKunstnerindtryk af computerdesignede miniproteinbindere rettet mod influenzahæmagglutinin. Mange binder og neutraliserer effektivt virussen. Kredit:Cognition Studio Seattle, Daniel-Adriano Silva og La -
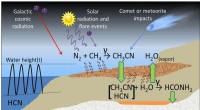 Opstod vandbaseret liv uden vand?Foreslået proces til formamidsyntese nær radioaktive mineralaflejringer på Jordens overflade. Kredit:Adam et al. Udgivet i Videnskabelige rapporter . Når man forsøger at forstå oprindelsen af
Opstod vandbaseret liv uden vand?Foreslået proces til formamidsyntese nær radioaktive mineralaflejringer på Jordens overflade. Kredit:Adam et al. Udgivet i Videnskabelige rapporter . Når man forsøger at forstå oprindelsen af -
 Ny test giver nøjagtige mål for DNA-skader fra kemiske forbindelserKredit:CC0 Public Domain En ny biomarkørtest udviklet af forskere ved Georgetown Lombardi Comprehensive Cancer Center og deres kolleger kan hjælpe med at forudsige, med op til 90 procent sikkerhed
Ny test giver nøjagtige mål for DNA-skader fra kemiske forbindelserKredit:CC0 Public Domain En ny biomarkørtest udviklet af forskere ved Georgetown Lombardi Comprehensive Cancer Center og deres kolleger kan hjælpe med at forudsige, med op til 90 procent sikkerhed


