Mini-protein hurtig designmetode åbner vejen for at skabe en ny klasse af lægemidler

Kunstnerindtryk af computerdesignede miniproteinbindere rettet mod influenzahæmagglutinin. Mange binder og neutraliserer effektivt virussen. Kredit:Cognition Studio Seattle, Daniel-Adriano Silva og Lance Stewart/UW Medicine
Forskere har skabt en højhastighedsmetode til at generere tusindvis af forskellige, lille, stabile proteiner fra bunden, der kan specialdesignes til at binde til specifikke terapeutiske mål.
Beskyttelse mod infektionssygdomme, som influenza, og modgift mod nervetoksiner er kun to forskningsmål med denne tilgang. Metoden frembringer hurtigt tusindvis af nye lægemiddelkandidater.
Disse computerdesignede proteiner, som ikke tidligere har eksisteret i naturen, kombinere stabiliteten og biotilgængeligheden af små molekyle lægemidler med specificiteten og styrken af større biologiske lægemidler.
"Disse mini-proteinbindere har potentialet til at blive en ny klasse af lægemidler, der bygger bro mellem småmolekylære lægemidler og biologiske lægemidler. Ligesom monoklonale antistoffer, de kan designes til at binde sig til mål med høj selektivitet, men de er mere stabile og nemmere at producere og administrere, " sagde David Baker, der ledede det multiinstitutionelle forskningsprojekt.
Baker er professor i biokemi ved University of Washington School of Medicine og direktør for UW Institute for Protein Design. Han er også efterforsker ved Howard Hughes Medical Institute.
Baker og hans kolleger rapporterer deres resultater i en artikel offentliggjort online den 27. september af tidsskriftet Natur .
Aaron Chevalier, Daniel-Adriano Silva og Gabriel J. Rocklin var hovedforfatterne og var alle seniorstipendiater ved UW Institute for Protein Design på tidspunktet for projektet.
Metoden brugte en computerplatform, kaldet Rosetta, udviklet af Baker og kolleger ved University of Washington. De designede tusindvis af korte proteiner, omkring 40 aminosyrer lange, at Rosetta-programmet forudsagde ville binde tæt til det molekylære mål.
På grund af deres lille størrelse, disse korte proteiner har tendens til at være ekstremt stabile. De kan opbevares uden køl. De er også nemmere at administrere end store proteinlægemidler, såsom monoklonale antistoffer.
Tidligere, så kort, protein-bindemidler var typisk re-konstruerede versioner af naturligt forekommende proteiner. Disse, imidlertid, tendens til ikke at være signifikant bedre end monoklonale antistoffer.
Fordi disse mini-proteinbindere er originale designs, de kan skræddersyes til at passe deres mål meget tættere og er nemmere at ændre og forfine.
I dette studie, forskerne søgte at designe to sæt af disse proteiner:et sæt, der ville forhindre influenzavirus i at invadere celler, og et andet, der ville binde til og neutralisere et dødeligt nervetoksin fra botulisme. Dette toksin betragtes som et potentielt biovåben.
Computermodelleringen identificerede aminosyresekvenserne af tusindvis af korte proteiner, der ville passe ind i og binde sig til influenza- og botulinum-målene. Forskerne skabte korte stykker DNA, der kodede hvert af disse proteiner, dyrkede proteiner i gærceller, og så på, hvor tæt de bundet til deres mål. Målene var influenza H1 hæmagglutinin og botulinum neurotoksin B.
Alt i alt, metoden tillod dem at designe og teste 22, 660 proteiner på få måneder. Mere end to tusinde af dem bundet til deres mål med høj affinitet.
Evaluering af de bedste kandidater viste, at anti-influenza-proteinerne neutraliserede vira i cellekultur og andre designet proteiner forhindrede botulinumtoksinet i at trænge ind i hjerneceller.
En næsespray indeholdende et af de specialdesignede proteiner beskyttede mus fuldstændigt mod influenza, hvis de blev administreret før eller så meget som 72 timer efter eksponering. rapporterer forskerne.
Test af en delmængde af proteinerne viste, at de var ekstremt stabile og, i modsætning til antistoffer, blev ikke inaktiveret af høje temperaturer. De små proteiner udløste også ringe eller ingen immunrespons, et problem, der ofte gør større proteinlægemidler ineffektive.
 Varme artikler
Varme artikler
-
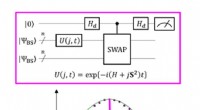 Gentænke spinkemi fra et kvanteperspektivEt kvantekredsløb, der muliggør den maksimale sandsynlighed for P(0) ved måling af parameteren J. Kredit:K. Sugisaki, K. Sato og T. Takui Forskere ved Osaka City University bruger kvantesuperposit
Gentænke spinkemi fra et kvanteperspektivEt kvantekredsløb, der muliggør den maksimale sandsynlighed for P(0) ved måling af parameteren J. Kredit:K. Sugisaki, K. Sato og T. Takui Forskere ved Osaka City University bruger kvantesuperposit -
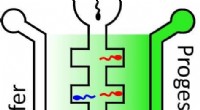 En ny måde at vurdere mandlig fertilitet påMere sædceller bevæger sig til højre side af en central kanal, som indeholder høje koncentrationer af progesteron (mørkegrøn), end til venstre side, som indeholder lavere koncentrationer (lysegrøn). K
En ny måde at vurdere mandlig fertilitet påMere sædceller bevæger sig til højre side af en central kanal, som indeholder høje koncentrationer af progesteron (mørkegrøn), end til venstre side, som indeholder lavere koncentrationer (lysegrøn). K -
 Et mere modstandsdygtigt materiale mod mikroorganismer skabes for at genoprette kulturarvenUndersøgelsen blev udført af et forskerhold ved universitetets forskningsinstitut i finkemi og nanokemi ved universitetet i Cordoba og Sevillas institut for naturressourcer og agrobiologi fra det span
Et mere modstandsdygtigt materiale mod mikroorganismer skabes for at genoprette kulturarvenUndersøgelsen blev udført af et forskerhold ved universitetets forskningsinstitut i finkemi og nanokemi ved universitetet i Cordoba og Sevillas institut for naturressourcer og agrobiologi fra det span -
 Forskere afkoder dynamikken i den største proteinnedbrydende maskine i atomare detaljerKredit:CC0 Public Domain Protein nanomaskiner lavet af flere proteinmolekyler er meget dynamiske under deres handlinger på deres funktionelle mål, nogle gange kaldet substrater. Dynamikken af di
Forskere afkoder dynamikken i den største proteinnedbrydende maskine i atomare detaljerKredit:CC0 Public Domain Protein nanomaskiner lavet af flere proteinmolekyler er meget dynamiske under deres handlinger på deres funktionelle mål, nogle gange kaldet substrater. Dynamikken af di
- Æbletræer bærer mere frugt, når de er omgivet af gode naboer
- Geofysiker er stadig optimistisk med hensyn til det arktiske ozonlag trods stort hul
- Sådan viser du GPM-vandflow på en eksisterende Chiller
- Comet giver en sjælden chance for at studere solsystemernes oprindelse
- Miljøforurenende stoffer kan påvirke cellulære tegn på aldring
- DNA origami fuld af potente kræftfremkaldende midler


