Ifa metal danner to oxider Den højere oxid indeholder 80 metal 0,72 g lavere gav 0,8 g, når oxideret viser, at disse data illustrerer lovmultiplikation?
forståelse af loven i flere proportioner
Loven i flere proportioner hedder, at når to elementer danner mere end en forbindelse, er forholdet mellem masserne af det ene element, der kombineres med en fast masse af det andet element, enkle hele tal.
analyse af dataene
* Højere oxid: Vi får at vide, at det højere oxid indeholder 80% metal. Dette betyder, at 80 gram for hver 100 gram af oxidet er metal, og de resterende 20 gram er ilt.
* Nedre oxid:
* Vi starter med 0,72 gram af den nedre oxid.
* Efter oxidation bliver det 0,8 gram. Dette betyder, at 0,08 gram ilt blev tilsat til det nedre oxid.
* Da metallet i den nedre oxid forbliver konstant, kan vi udlede, at den originale 0,72 gram indeholdt 0,72 - 0,08 =0,64 gram metal.
Beregning af masseforholdet
Lad os nu beregne masseforhold af ilt og metal i hvert oxid:
* Højere oxid: Oxygen/metal =20/80 =1/4
* Nedre oxid: Ilt/metal =0,08/0,64 =1/8
Anvendelse af loven i flere proportioner
Bemærk, at forholdet mellem ilt og metal i det højere oxid (1/4) er nøjagtigt dobbelt så stort som forholdet mellem ilt og metal i det lavere oxid (1/8).
Dette bekræfter loven i flere proportioner:Masserne af ilt, der kombineres med en fast masse metal i de to oxider, er i et enkelt forhold mellem hele antallet (1:2).
Konklusion
De givne data illustrerer perfekt loven i flere proportioner. De to oxider af metallet viser, at forholdet mellem massen af ilt, der kombinerer med en fast masse af metallet, er et simpelt forhold mellem hele tal (1:2).
Sidste artikelHvilken type krystallinsk struktur besidder kobolt?
Næste artikelEr det at blande en fysisk eller kemisk egenskab?
 Varme artikler
Varme artikler
-
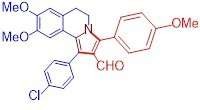 En række stoffer med antitumor -egenskaber syntetiseretStrukturen af en af de resulterende forbindelser (2-aryl-5, 6-dihydropyrrolo [2, 1-α] isoquinoline) Kredit:Maria Matveeva Forskere fra RUDN University har syntetiseret en række nye cytotoksisk
En række stoffer med antitumor -egenskaber syntetiseretStrukturen af en af de resulterende forbindelser (2-aryl-5, 6-dihydropyrrolo [2, 1-α] isoquinoline) Kredit:Maria Matveeva Forskere fra RUDN University har syntetiseret en række nye cytotoksisk -
 Alger puster liv i 3D-konstrueret vævEt biotrykt lobulelignende mønster indeholdende algerne, hvor tæt indkapslede celler er synlige. Til venstre er et optisk mikrofotografi, mens den højre viser et autofluorescensmikrofotografi. Kredit:
Alger puster liv i 3D-konstrueret vævEt biotrykt lobulelignende mønster indeholdende algerne, hvor tæt indkapslede celler er synlige. Til venstre er et optisk mikrofotografi, mens den højre viser et autofluorescensmikrofotografi. Kredit: -
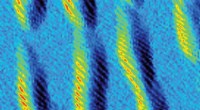 Polymerer klikker sammen ved hjælp af grøn kemiDisse fjederlignende strukturer er spiralformede polymerer. De spiralformede spoler er angivet med lyse striber i dette sidebillede af de små molekylestore tråde, der ligger på en overflade. Et team a
Polymerer klikker sammen ved hjælp af grøn kemiDisse fjederlignende strukturer er spiralformede polymerer. De spiralformede spoler er angivet med lyse striber i dette sidebillede af de små molekylestore tråde, der ligger på en overflade. Et team a -
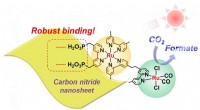 Nyt kulnitridmateriale kombineret med ruthenium forbedrer CO2-reduktionen i synligt lys i vandForskere observerede robust binding mellem rutheniummetalkomplekset og carbonnitrid nanoplader under synligt lys i vandig opløsning. Kredit: Angew. Chem. Med den igangværende udtømning af fossile
Nyt kulnitridmateriale kombineret med ruthenium forbedrer CO2-reduktionen i synligt lys i vandForskere observerede robust binding mellem rutheniummetalkomplekset og carbonnitrid nanoplader under synligt lys i vandig opløsning. Kredit: Angew. Chem. Med den igangværende udtømning af fossile
- Giv en brug af termisk ekspansion i gasser?
- Hvordan ser elektromagnetisk energi ud?
- Superkoraller giver et glimt af håb for verdens døende rev
- Hvordan teknologi og robotteknologi hjælper Brasilien med at overvåge kontrol med en invasiv koral…
- Hvorfor gør månen tidligt om aftenen?
- Hvor mange gram er lig med 9 kg?


