Hvorfor har svovl hexafluorid et lavt kogepunkt?
* Stærke London Dispersion Forces: SF6 er et stort molekyle med en høj molekylvægt. Den store elektronsky skaber stærke midlertidige dipoler, hvilket fører til betydelige London -spredningskræfter. Disse kræfter er de primære intermolekylære interaktioner i SF6.
* ikke -polær natur: SF6 er et ikke -polært molekyle på grund af dets symmetriske octahedrale form. Dette betyder, at det mangler dipol-dipol-interaktioner, som typisk er stærkere end London-spredningskræfter.
* høj molekylvægt: Den høje molekylvægt af SF6 (146 g/mol) bidrager til de stærke London -spredningskræfter.
Samlet set resulterer kombinationen af stærke London -spredningskræfter og dens ikke -polære natur i et relativt højt kogepunkt for SF6 (ca. -64 ° C).
Det er vigtigt at bemærke, at selvom SF6 har et højt kogepunkt sammenlignet med mange andre gasser som helium eller nitrogen, betragtes det stadig som en gas ved stuetemperatur.
 Varme artikler
Varme artikler
-
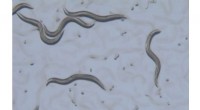 Orme som model for personlig medicinC. elegans set gennem et mikroskop. Kredit:Billedkredit:Bingsen Zhang. At skræddersy en persons kost eller medicin baseret på deres genomer har været et mål for det medicinske samfund i årtier, men
Orme som model for personlig medicinC. elegans set gennem et mikroskop. Kredit:Billedkredit:Bingsen Zhang. At skræddersy en persons kost eller medicin baseret på deres genomer har været et mål for det medicinske samfund i årtier, men -
 Solcreme og kosmetikforbindelser kan skade koraller ved at ændre fedtsyrerKredit:American Chemical Society Selvom solcreme er afgørende for at forebygge solskoldninger og hudkræft, nogle af dets ingredienser er ikke så gavnlige for havlevende skabninger. I særdeleshed,
Solcreme og kosmetikforbindelser kan skade koraller ved at ændre fedtsyrerKredit:American Chemical Society Selvom solcreme er afgørende for at forebygge solskoldninger og hudkræft, nogle af dets ingredienser er ikke så gavnlige for havlevende skabninger. I særdeleshed, -
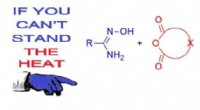 Kemikere udvikler en lovende lægemiddelsyntesemetodeGrafisk abstrakt til artiklen. Hentydning til ordsproget om Truman. Kredit:Anton Sehtnev Forskere fra RUDN University har sammen med deres kolleger fra Yaroslavl udviklet en ny måde at syntetisere
Kemikere udvikler en lovende lægemiddelsyntesemetodeGrafisk abstrakt til artiklen. Hentydning til ordsproget om Truman. Kredit:Anton Sehtnev Forskere fra RUDN University har sammen med deres kolleger fra Yaroslavl udviklet en ny måde at syntetisere -
 Enhed, der anvender molekylær teknik, kunne give ultrafølsomme, automatiseret system til at opdage…Jacqueline Linnes, en assisterende professor ved Purdues Weldon School of Biomedical Engineering, udvikler nukleinsyreamplifikationstest trykt på papir for at muliggøre en lav pris, automatiseret syst
Enhed, der anvender molekylær teknik, kunne give ultrafølsomme, automatiseret system til at opdage…Jacqueline Linnes, en assisterende professor ved Purdues Weldon School of Biomedical Engineering, udvikler nukleinsyreamplifikationstest trykt på papir for at muliggøre en lav pris, automatiseret syst
- Hvilket af følgende er en form intern kinetisk og potentiel energi indeholdt i et objekt, der er fo…
- Hvad er det første kontinent på jorden?
- Hvorfor er konstellationerne væk i tid på en måned?
- Forskere skabte en umulig superledende forbindelse
- Hvad er delvis parasit?
- Bangkok flyver med droner, advarer om strabadser i dårlig luftslag


