Hvad er dannelsesvarmen SO2?
Dette betyder, at dannelsen af en mol SO₂ fra dens elementer (svovl og ilt) i deres standardtilstande frigiver 296,83 kJ varme.
Her er reaktionen for den standard entalpi af dannelse:
S (S) + O₂ (G) → SO₂ (G) ΔH ° F =-296,83 kJ/mol
Vigtige noter:
* Standardbetingelser: Denne værdi gives under standardbetingelser (298 K og 1 atm).
* eksotermisk reaktion: Det negative tegn indikerer, at reaktionen er eksoterm, hvilket betyder, at varme frigøres under dannelsen af SO₂.
* Andre kilder: Du finder måske lidt forskellige værdier for dannelsesvarmen afhængigt af kilden. Disse uoverensstemmelser er normalt mindre og skyldes variationer i målemetoder eller brugen af forskellige referencetilstande.
 Varme artikler
Varme artikler
-
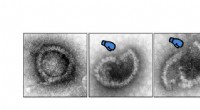 Et skridt på vejen mod bedre behandlinger mod viraEt elektronmikroskopbillede. Det viser, hvordan herpesvirus angribes af proteinet MxB. Kredit:Manutea Serrero &Beate Sodeik, Virology, Hannover Medical School, Tyskland. De fleste celler kan forsva
Et skridt på vejen mod bedre behandlinger mod viraEt elektronmikroskopbillede. Det viser, hvordan herpesvirus angribes af proteinet MxB. Kredit:Manutea Serrero &Beate Sodeik, Virology, Hannover Medical School, Tyskland. De fleste celler kan forsva -
 Forskere trykker på lasere for at efterligne hajhud, andre naturlige overfladerCraig Zuhlke (til venstre), en forskningsadjunkt, og Aaron Ediger, en færdiguddannet forskningsassistent, se, hvordan en laser modificerer en lille prøve af metal. Forskningen, ledet af Nebraskas Denn
Forskere trykker på lasere for at efterligne hajhud, andre naturlige overfladerCraig Zuhlke (til venstre), en forskningsadjunkt, og Aaron Ediger, en færdiguddannet forskningsassistent, se, hvordan en laser modificerer en lille prøve af metal. Forskningen, ledet af Nebraskas Denn -
 Ny belægning kan have store konsekvenser for litiumbatterierArgonne -forskere har udviklet en ny belægning (vist med blå) til batterikatoder, der kan forbedre batteriets elektroniske og ioniske ledningsevne og samtidig forbedre dets sikkerhed og cykelydelse. K
Ny belægning kan have store konsekvenser for litiumbatterierArgonne -forskere har udviklet en ny belægning (vist med blå) til batterikatoder, der kan forbedre batteriets elektroniske og ioniske ledningsevne og samtidig forbedre dets sikkerhed og cykelydelse. K -
 Forskere forbedrer processen til at omdanne svært genanvendeligt plastikaffald til brændstofHilal Ezgi Toraman, Virginia S. og Philip L. Walker Jr. Fakultetsstipendiat i John og Willie Leone Family Department of Energy and Mineral Engineering i Penn State. Kredit:Penn State University At
Forskere forbedrer processen til at omdanne svært genanvendeligt plastikaffald til brændstofHilal Ezgi Toraman, Virginia S. og Philip L. Walker Jr. Fakultetsstipendiat i John og Willie Leone Family Department of Energy and Mineral Engineering i Penn State. Kredit:Penn State University At
- Hvad er grundtilstandselektronkonfigurationen gallium?
- Hvor meget energi frigiver solen?
- En galakse, der udsender en unormalt stor mængde energi i den infrarøde radio-ultraviolet og rønt…
- Deling af de erfaringer, der blev taget under Colorado -oversvømmelsen i 2013
- Hvad producerer hydrogenperoxid og brand?
- Bedre adskillelser med tilpassede nanopartikelmembraner


