Hvordan dannes gashydrater?
1. Tilstedeværelse af vand og gas: De vigtigste ingredienser er vand (H2O) og en gas, typisk metan (CH4), men andre gasser som ethan, propan og kuldioxid kan også danne hydrater.
2. Lav temperatur og højt tryk: Gashydrater er stabile under specifikke temperatur- og trykforhold. Trykket skal være højt nok til at tvinge gasmolekylerne ind i vandmolekylerne. Temperaturen skal være lav nok til at give gasmolekylerne mulighed for at binde med vandmolekylerne.
3. Dannelse:
* burlignende struktur: Vandmolekyler danner en burlignende struktur kendt som et clathrate. Gasmolekylerne bliver fanget inde i disse bure.
* Hydrering: Gasmolekylerne danner svage bindinger med vandmolekylerne, hvilket skaber en solid krystallinsk struktur.
4. Stabilitetsbetingelser: Stabiliteten af gashydrater afhænger af:
* type gas: Forskellige gasser har forskellige hydratdannelsesbetingelser. Metan danner hydrater ved lavere tryk og temperaturer end andre gasser.
* tryk: Favør dannelse af højere tryk hydrat.
* Temperatur: Nedre temperatur favoriserer dannelse af hydrat.
* tilstedeværelse af salte: Salte kan hindre dannelse af hydrat, da de forstyrrer vandmolekylstrukturen.
placeringer, hvor gashydrater findes:
* Ocean Floor: Store mængder gashydrater findes i marine sedimenter, især på dybder, hvor temperaturen og trykket er egnede.
* permafrost: Gashydrater forekommer også i permafrostregioner, hvor jorden er permanent frosset.
* dybe reservoirer: Gashydrater findes i dybe geologiske formationer, hvor olie og naturgas er til stede.
Betydningen af gashydrater:
* Potentiel energikilde: Gashydrater indeholder betydelige mængder metan, en værdifuld energikilde.
* Klimaændringer: Frigivelsen af metan fra gashydrater kan bidrage til global opvarmning.
* Geologiske farer: Gashydratdissociation kan forårsage ustabilitet i havbunden, hvilket fører til jordskred og tsunamier.
At forstå dannelsen og stabiliteten af gashydrater er afgørende for at styre deres potentiale som en energiressource og afbøde deres miljømæssige og geologiske risici.
Sidste artikelHvorfor gennemgår forbindelser elektrolyse?
Næste artikelEr alkohol mere opløselig i benzen eller alkan?
 Varme artikler
Varme artikler
-
 Big data-teknik afslører hidtil ukendte muligheder for almindelige materialerKredit:CC0 Public Domain Når forskere og ingeniører opdager nye måder at optimere eksisterende materialer på, det baner vejen for innovationer, der gør alt fra vores telefoner og computere til vor
Big data-teknik afslører hidtil ukendte muligheder for almindelige materialerKredit:CC0 Public Domain Når forskere og ingeniører opdager nye måder at optimere eksisterende materialer på, det baner vejen for innovationer, der gør alt fra vores telefoner og computere til vor -
 Gør masker smartere og sikrere mod COVID-19Kredit:University of California - San Diego Et nyt værktøj til overvågning af COVID-19 kan en dag være lige under næsen på dig. Forskere ved University of California San Diego er ved at udvikle en
Gør masker smartere og sikrere mod COVID-19Kredit:University of California - San Diego Et nyt værktøj til overvågning af COVID-19 kan en dag være lige under næsen på dig. Forskere ved University of California San Diego er ved at udvikle en -
 Plantebaserede og genanvendelige plastikflasker med citrusskal som råmaterialeKredit:Pixabay/CC0 Public Domain Skiftet fra fossilbaseret til vedvarende bioplast kræver nye effektive metoder. Ny teknologi udviklet på VTT muliggør brugen af pektinholdigt landbrugsaffald, så
Plantebaserede og genanvendelige plastikflasker med citrusskal som råmaterialeKredit:Pixabay/CC0 Public Domain Skiftet fra fossilbaseret til vedvarende bioplast kræver nye effektive metoder. Ny teknologi udviklet på VTT muliggør brugen af pektinholdigt landbrugsaffald, så -
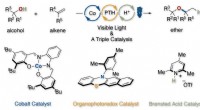 Udvikling af en ny metode til syntetisering af dialkylethere ved hjælp af tre katalysatorer, der hy…Præcis kontrol af protoner og elektroner ved fotoredox/cobalt/Brønsted syrekatalyse giver værdifulde dialkylethere fra let tilgængelige alkoholer og alkener uden stærke syrer. Kredit:KyotoU/Hirohisa O
Udvikling af en ny metode til syntetisering af dialkylethere ved hjælp af tre katalysatorer, der hy…Præcis kontrol af protoner og elektroner ved fotoredox/cobalt/Brønsted syrekatalyse giver værdifulde dialkylethere fra let tilgængelige alkoholer og alkener uden stærke syrer. Kredit:KyotoU/Hirohisa O
- Hvad er gråt metal, der reagerer med vand?
- Reproducerer Bakers gær seksuelt eller begge dele?
- Hvad er den værste seismiske bølge?
- Vinteren er en vigtig drivkraft for lattergasemissioner fra boreale søer
- Hvad er det fysiske begreb om kraftfriktion og masse?
- Hvor mange uparrede elektroner har silicium og lithium?


