Hvorfor gennemgår forbindelser elektrolyse?
Elektrolyse er processen med at bruge elektrisk strøm til at drive en ikke-spontan kemisk reaktion. På enklere termer tvinger det en kemisk ændring ved at tilvejebringe den nødvendige energi gennem elektricitet.
Forbindelser kan opdeles i deres bestanddele eller ioner gennem elektrolyse, hvis de opfylder visse kriterier:
* de skal være i en smeltet tilstand eller opløst i et passende opløsningsmiddel (elektrolyt). Dette gør det muligt for ionerne at bevæge sig frit og bære den elektriske strøm.
* de skal være ioniske forbindelser eller have en betydelig ionisk karakter. Dette betyder, at forbindelsen skal have let tilgængelige ioner til de elektrokemiske reaktioner, der kan forekomme.
Eksempler på elektrolyse, der involverer forbindelser:
* Elektrolyse af vand (H₂O): Dette opdeler vand i brintgas (H₂) og iltgas (O₂).
* elektrolyse af smeltet natriumchlorid (NaCl): Dette producerer natriummetal (NA) og chlorgas (CL₂).
* elektroplettering: Dette involverer anvendelse af elektrolyse til at deponere et tyndt lag metal på et objekt, der ofte bruges til dekorative eller beskyttende formål.
Hvorfor nogle forbindelser er muligvis ikke egnede til elektrolyse:
* kovalente forbindelser med stærke bindinger: Mange kovalente forbindelser har stærke bindinger, der kræver en masse energi for at bryde. Disse forbindelser gennemgår muligvis ikke let elektrolyse.
* Uopløselige forbindelser: Hvis en forbindelse er uopløselig, danner den ikke ioner i opløsning, hvilket gør det vanskeligt at udføre elektrolyse.
Konklusion:
Selvom det er sandt, at nogle forbindelser ikke gennemgår elektrolyse, er det ikke en universel regel. Mange forbindelser kan opdeles eller ændres ved hjælp af denne proces, afhængigt af deres kemiske egenskaber og betingelserne for elektrolyse.
Sidste artikelHvor mange elektroner kredserer nitrogener kerne?
Næste artikelHvordan dannes gashydrater?
 Varme artikler
Varme artikler
-
 Video:Hvordan drageblod kunne redde dit livKredit:The American Chemical Society Kemikere har fundet potentielle lægemidler og andre virkelig nyttige forbindelser nogle virkelig bizarre steder i naturen. For eksempel, et naturligt immunfor
Video:Hvordan drageblod kunne redde dit livKredit:The American Chemical Society Kemikere har fundet potentielle lægemidler og andre virkelig nyttige forbindelser nogle virkelig bizarre steder i naturen. For eksempel, et naturligt immunfor -
 Forskere formår at forbedre metalliske brillerMetallisk glasprøve. Kredit:NUST MISIS Forskere ved National University of Science and Technology MISIS (NUST MISIS) har formået at udvikle en unik metode til behandling af store glas i metal. Ifø
Forskere formår at forbedre metalliske brillerMetallisk glasprøve. Kredit:NUST MISIS Forskere ved National University of Science and Technology MISIS (NUST MISIS) har formået at udvikle en unik metode til behandling af store glas i metal. Ifø -
 En naturinspireret belægning for at forhindre, at stoffer nedbrydes for tidligtForskere har udviklet en tynd belægning, der kan gøre det muligt for medicin at have færre tilsætningsstoffer. Kredit:Shutterstock.com Kemikere har udviklet en belægning, der kan gøre visse lægemi
En naturinspireret belægning for at forhindre, at stoffer nedbrydes for tidligtForskere har udviklet en tynd belægning, der kan gøre det muligt for medicin at have færre tilsætningsstoffer. Kredit:Shutterstock.com Kemikere har udviklet en belægning, der kan gøre visse lægemi -
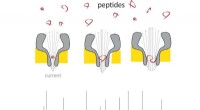 Nanoporer gør det bærbare massespektrometer til peptider til virkelighedEt peptid kommer ind i den tynde ende af nanoporen, og der ændrer strømmen i forhold til dens masse. Ved at bruge forskellig størrelse nanoporer, en række peptidstørrelser kan måles. Kredit:G. Maglia
Nanoporer gør det bærbare massespektrometer til peptider til virkelighedEt peptid kommer ind i den tynde ende af nanoporen, og der ændrer strømmen i forhold til dens masse. Ved at bruge forskellig størrelse nanoporer, en række peptidstørrelser kan måles. Kredit:G. Maglia
- Bekræftelsesfejl:Jeg tror, derfor er det sandt
- Avanceret undersøgelse viser, at tænder kan bruges til at bestemme, hvad der er blevet spist
- Undersøgelse identificerer øget trussel mod kystlinjer fra samtidige hedebølger og havniveaustign…
- Sådan fungerer Orion CEV
- Varmer op for at gøre tordenvejr større og hyppigere (opdatering)
- Sådan skriver du noter om en TI-84 Silver Edition Calculator


