Hvad er Seaborgiums almindelige forbindelser?
Her er hvorfor:
* kort halveringstid: Seaborgium-isotoper har meget korte halveringstider, der spænder fra millisekunder til et par minutter. Dette betyder, at de forfaldne hurtigt, hvilket gør det udfordrende at studere deres egenskaber og potentielle forbindelser.
* begrænset produktion: Produktion af Seaborgium kræver sofistikerede nukleare reaktioner, og kun meget små mængder kan produceres. Dette begrænser tilgængeligheden af elementet til forskning.
* reaktivitet: Seaborgium forventes at være meget reaktive og danner forbindelser, der ligner dem i wolfram (W). På grund af sin korte halveringstid er det imidlertid vanskeligt at observere og karakterisere disse forbindelser.
På trods af disse udfordringer har nogle forskere været i stand til at studere den kemiske opførsel af Seaborgium ved hjælp af sofistikerede teknikker. For eksempel har eksperimenter indikeret, at Seaborgium kan danne flygtige forbindelser som oxyhalider (SGO2CL2, SGO2BR2).
Imidlertid er disse observationer begrænset, og yderligere forskning er nødvendig for at forstå den komplette kemiske opførsel af dette element og dets potentielle forbindelser.
Sidste artikelEt stof, der danner hydroxidioner?
Næste artikelHvilke reaktanter ville give kaliumnitratkuldioxidvand?
 Varme artikler
Varme artikler
-
 Teamet opdager protein, lipidforbindelse, der kan hjælpe nye influenzabehandlingerKredit:University of Maine Forbindelsen mellem et influenzavirusoverfladeprotein og et værtscellelipid er blevet opdaget af forskere ved University of Maine og National Institutes of Health. Bekræ
Teamet opdager protein, lipidforbindelse, der kan hjælpe nye influenzabehandlingerKredit:University of Maine Forbindelsen mellem et influenzavirusoverfladeprotein og et værtscellelipid er blevet opdaget af forskere ved University of Maine og National Institutes of Health. Bekræ -
 Ny undersøgelse bekræfter bølget arkproteinstruktur forudsagt i 1953Det krusede betaark er en variation af det plisserede betaark, et velkendt strukturelt motiv, der findes i tusindvis af proteiner. Linus Pauling og Robert Corey beskrev det krusede beta-ark i 1953, me
Ny undersøgelse bekræfter bølget arkproteinstruktur forudsagt i 1953Det krusede betaark er en variation af det plisserede betaark, et velkendt strukturelt motiv, der findes i tusindvis af proteiner. Linus Pauling og Robert Corey beskrev det krusede beta-ark i 1953, me -
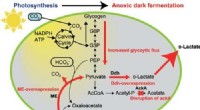 Metoden giver høj mængde af D-lactat ved hjælp af cyanobakterier, kunne revolutionere produktione…Figur 1:Vejen til omdannelse af kuldioxid til D-laktat. Synechocystis sp. PCC 6803 producerer glykogen inde i sine celler fra CO2 og lys. Det blev afsløret, at når Synechocystis sp. PCC 6803, der har
Metoden giver høj mængde af D-lactat ved hjælp af cyanobakterier, kunne revolutionere produktione…Figur 1:Vejen til omdannelse af kuldioxid til D-laktat. Synechocystis sp. PCC 6803 producerer glykogen inde i sine celler fra CO2 og lys. Det blev afsløret, at når Synechocystis sp. PCC 6803, der har -
 Innovativ katalytisk reaktion til billig syntese af aromatiske estereKredit:CC0 Public Domain Aromatiske estere er kemikalier, der indeholder en aromatisk ring bestående af funktionelle grupper kaldet estere. Disse organiske forbindelser bruges i vid udstrækning so
Innovativ katalytisk reaktion til billig syntese af aromatiske estereKredit:CC0 Public Domain Aromatiske estere er kemikalier, der indeholder en aromatisk ring bestående af funktionelle grupper kaldet estere. Disse organiske forbindelser bruges i vid udstrækning so
- Hvad bølgelængden af en 3 gange 10 12 Hz infrarød bølge?
- Brug af en algoritme til at reducere energiregningen – regn eller solskin
- Hvor mange atomer af carbon reagerer med et molekyle -ilt til dannelse af monoxid?
- Den mest almindelige karakter af metamorfe rock er?
- Hvad er et materiale, som varmen ikke bevæger sig gennem let kaldet?
- Hvor mange brintmolekyler indeholder vand?


