Hvilken type forbindelse er mest sandsynligt at være en stærk elektrolyt?
* ioniske forbindelser: Disse forbindelser dannes af den elektrostatiske tiltrækning mellem positivt ladede ioner (kationer) og negativt ladede ioner (ANION). Når de opløses i vand, overvindes de stærke elektrostatiske kræfter, der holder ionerne sammen, ved attraktionen af ionerne til de polære vandmolekyler. Dette fører til fuldstændig dissociation af den ioniske forbindelse i dens bestanddele, hvilket gør det til en stærk elektrolyt.
* Eksempler: NaCl (natriumchlorid), KBR (kaliumbromid), CaCl₂ (calciumchlorid), MGSO₄ (magnesiumsulfat)
* Stærke syrer: Disse syrer ioniserer fuldstændigt i opløsning og frigiver hydrogenioner (H⁺) og en anion.
* Eksempler: HCI (saltsyre), Hno₃ (salpetersyre), H₂so₄ (svovlsyre)
* Stærke baser: Disse baser adskiller sig fuldstændigt i opløsning og frigiver hydroxidioner (OH⁻) og en kation.
* Eksempler: NaOH (natriumhydroxid), KOH (kaliumhydroxid), BA (OH) ₂ (bariumhydroxid)
nøglepunkter at huske:
* opløselighed: Mens mange ioniske forbindelser er stærke elektrolytter, er nogle ikke meget opløselige i vand. Hvis en forbindelse ikke opløses godt, kan den ikke ionisere fuldt ud og ville derfor ikke være en stærk elektrolyt.
* svage syrer og baser: Svage syrer og baser ioniseres kun delvist i opløsningen. De producerer ioner, men ikke i samme omfang som stærke syrer og baser, hvilket gør dem svage elektrolytter.
Fortæl mig, hvis du gerne vil have eksempler på specifikke stærke elektrolytter!
Sidste artikelHvordan fremstiller du glycin natriumhydroxidbuffer pH 9,2 1M?
Næste artikelGør natriumpolyacrylat og vand en kemisk reaktion?
 Varme artikler
Varme artikler
-
 En ny måde at levere lysfølsomme lægemidler til at bekæmpe problemet med antibiotikaresistensKredit:CC0 Public Domain Queens University-forsker P. Andrew Evans har afsløret en ny proces til at levere antibiotika ved hjælp af pollen til at beskytte dem. Antibiotika er kraftfuld medicin, d
En ny måde at levere lysfølsomme lægemidler til at bekæmpe problemet med antibiotikaresistensKredit:CC0 Public Domain Queens University-forsker P. Andrew Evans har afsløret en ny proces til at levere antibiotika ved hjælp af pollen til at beskytte dem. Antibiotika er kraftfuld medicin, d -
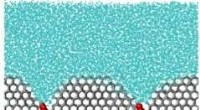 Polymerer til undsætning! Redder celler fra at beskadige isEn simulering af et ishæmmende molekyle. Molekylet, i rødt, er som en vægt på overfladen af iskrystallen, krum den og forhindrer yderligere iskrystalvækst. Kredit:University of Utah Celleterapie
Polymerer til undsætning! Redder celler fra at beskadige isEn simulering af et ishæmmende molekyle. Molekylet, i rødt, er som en vægt på overfladen af iskrystallen, krum den og forhindrer yderligere iskrystalvækst. Kredit:University of Utah Celleterapie -
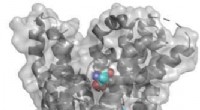 Proteinernæring til celler og organismer:Kan vi bruge det til behandling af sygdomme?Bindingsstedet for EAAT1-hæmmeren (UCPH101) opløses ved røntgenkrystallografi og er placeret i en afstand fra substratbindingsstedet. Substratet er vist i midten af transportøren, mens inhibitoren e
Proteinernæring til celler og organismer:Kan vi bruge det til behandling af sygdomme?Bindingsstedet for EAAT1-hæmmeren (UCPH101) opløses ved røntgenkrystallografi og er placeret i en afstand fra substratbindingsstedet. Substratet er vist i midten af transportøren, mens inhibitoren e -
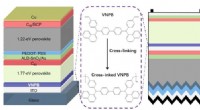 Tværbundne hultransportlag til højeffektive perovskit tandem solcellerSkematisk af perovskit/perovskite og perovskit/silicium tandem solceller. Kredit:© Science China Press Strømkonverteringseffektiviteten (PCE) for perovskite solceller med enkelt kryds (PSCer) er s
Tværbundne hultransportlag til højeffektive perovskit tandem solcellerSkematisk af perovskit/perovskite og perovskit/silicium tandem solceller. Kredit:© Science China Press Strømkonverteringseffektiviteten (PCE) for perovskite solceller med enkelt kryds (PSCer) er s
- Kemikere opdager, hvorfor fotosyntetisk lysindsamling er så effektiv
- Dele af en organisme, der har en vigtig rolle i at hjælpe levende ting med at fungere korrekt, kald…
- Hvad sker der med molekyler, når et stof fordamper?
- Grænsen mellem to tektoniske plader ligger under staten Californien. Interaktion Disse resultater, …
- Hvordan bruger nogle maskiner termisk energi til at arbejde?
- Udfordringerne ved et rumvæsen-rumflugtsprogram - at undslippe superjord og røde dværgstjerner


