Er hydrogenchloridgas en god leder af elektricitet?
* Mangel på gratis ladningsbærere: Hydrogenchloridgas findes som individuelle molekyler med en kovalent binding mellem brint- og chloratomer. Dette betyder, at der ikke er nogen gratis elektroner eller ioner, der er let tilgængelige til at bære en elektrisk strøm.
* Ikke-polær karakter: HCL er et polært molekyle, men i den gasformige tilstand er molekylerne langt fra hinanden, og deres polaritet fører ikke til betydelig ladningsadskillelse. Dette forhindrer dannelse af en elektrisk strøm.
Ting ændrer sig imidlertid, når hydrogenchlorid opløses i vand:
* Dannelse af ioner: HCL opløses let i vand, og reaktionen producerer hydroniumioner (H3O+) og chloridioner (Cl-). Disse ioner er frie til at flytte og kan udføre elektricitet.
* stærk elektrolyt: Den høje koncentration af ioner i en vandig opløsning af HCI gør det til en stærk elektrolyt, hvilket betyder, at den udfører elektricitet meget godt.
Kortfattet:
* gasformig HCL: Ikke en god leder af elektricitet.
* vandig HCL: En stærk leder af elektricitet.
Sidste artikelHvilken type binding holder natriumfluorid sammen?
Næste artikelEr massen af et hydrogenatom forskelligt fra et iltatom?
 Varme artikler
Varme artikler
-
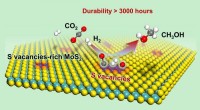 Katalytisk hydrogenering af kuldioxid til methanolForskere opnåede for første gang lavtemperatur højeffektiv hydrogenering af CO2 til methanol, med et langt arbejdsliv over svovlfri stillingsrige fålags MoS2, samt bemærkelsesværdigt højere aktivitet
Katalytisk hydrogenering af kuldioxid til methanolForskere opnåede for første gang lavtemperatur højeffektiv hydrogenering af CO2 til methanol, med et langt arbejdsliv over svovlfri stillingsrige fålags MoS2, samt bemærkelsesværdigt højere aktivitet -
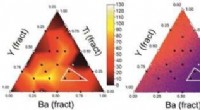 Opdager nye leads til funktionelle materialer styret af kunstig intelligensKredit:Wiley Søger efter blymaterialer med specifikke egenskaber, forskere har udviklet en arbejdsgang, der inkorporerer kunstig intelligens til at guide opdagelsen af en ny keramisk struktur me
Opdager nye leads til funktionelle materialer styret af kunstig intelligensKredit:Wiley Søger efter blymaterialer med specifikke egenskaber, forskere har udviklet en arbejdsgang, der inkorporerer kunstig intelligens til at guide opdagelsen af en ny keramisk struktur me -
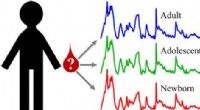 Brug af blodpletter på gerningssteder for at bestemme alderen på en mistænkt eller offerKredit:American Chemical Society Fra sprøjteanalysen gjort berømt i tv -programmet Dexter til den hyppige DNA -profilering af CSI og de reelle sager, der er omfattet af FBI filer , blodprøve
Brug af blodpletter på gerningssteder for at bestemme alderen på en mistænkt eller offerKredit:American Chemical Society Fra sprøjteanalysen gjort berømt i tv -programmet Dexter til den hyppige DNA -profilering af CSI og de reelle sager, der er omfattet af FBI filer , blodprøve -
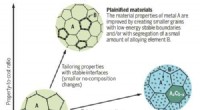 Plainification lover at forbedre materielle bæredygtighedMaterialernes ydeevne forbedres ofte ved at stabilisere grænseflader mellem korn ved at legere med andre elementer. (Billede af SYNL) Omfattende legering gør materialeudvikling mere afhængig af kn
Plainification lover at forbedre materielle bæredygtighedMaterialernes ydeevne forbedres ofte ved at stabilisere grænseflader mellem korn ved at legere med andre elementer. (Billede af SYNL) Omfattende legering gør materialeudvikling mere afhængig af kn
- Fysikere observerer spontan symmetri, der bryder i en optisk mikrohule
- 7 af de 10 hotteste lande i verden er på 1 kontinent
- Hvad er kvantestørrelseseffekten?
- Forskere opdager vejen til forbedret bygkvalitet
- Forståelse af de strukturelle og kemiske heterogeniteter af overfladearter ved enkeltbindingsgræns…
- Mængden af energi, som et system skal have, for at kemisk ændring finder sted?


