Er pH af opløsning negativ logaritme dens hydroxidionkoncentration?
PH af en opløsning er negativ logaritme for dens hydrogenionkoncentration , ikke hydroxidionkoncentrationen.
Her er sammenbruddet:
* ph: Et mål for surhedsgraden eller alkaliniteten af en opløsning.
* hydrogenioner (H+) :Ionerne, der er ansvarlige for surhedsgrad.
* hydroxidioner (OH-) :Ionerne, der er ansvarlige for alkalinitet.
Forholdet mellem pH og hydroxidionkoncentration er gennem POH -skalaen:
* poh :Den negative logaritme af hydroxidionkoncentrationen.
* forholdet mellem pH og POH: Ph + POH =14 (ved 25 ° C)
Eksempel:
Hvis pH i en opløsning er 3, er POH 11 (14 - 3 =11). Du kan derefter beregne hydroxidionkoncentrationen fra POH:
[Oh-] =10^(-poh) =10^(-11) m
Kortfattet:
* ph: Foranstaltninger Hydrogenionkoncentration (surhedsgrad)
* POH: Foranstaltninger Hydroxidionkoncentration (alkalinitet)
* pH og POH er relateret gennem ligningen:pH + POH =14
Sidste artikelHvilket element er stabilt med 2 valenselektroner?
Næste artikelDanner natrium og neon en ionisk forbindelse?
 Varme artikler
Varme artikler
-
 Kemikere skaber nyt kunstigt enzymVed hjælp af beregningskemi, kandidatstuderende Vindi M. Jayasinghe-Arachchige og Rajeev Prabhakar, professor i kemi, designet et nyt molekyle, der betydeligt kunne fremme undersøgelsen og anvendelsen
Kemikere skaber nyt kunstigt enzymVed hjælp af beregningskemi, kandidatstuderende Vindi M. Jayasinghe-Arachchige og Rajeev Prabhakar, professor i kemi, designet et nyt molekyle, der betydeligt kunne fremme undersøgelsen og anvendelsen -
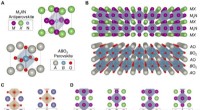 Epitaksiale antiperovskit/perovskite heterostrukturer til materialedesignSkematisk repræsentation af krystalstrukturerne af M3XN nitrid antiperovskite og ABO3 oxid perovskite forbindelser og deres grænseflader. (A) M3XN og ABO3 ideelle enhedsceller, der viser deres geometr
Epitaksiale antiperovskit/perovskite heterostrukturer til materialedesignSkematisk repræsentation af krystalstrukturerne af M3XN nitrid antiperovskite og ABO3 oxid perovskite forbindelser og deres grænseflader. (A) M3XN og ABO3 ideelle enhedsceller, der viser deres geometr -
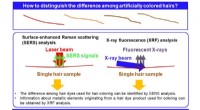 Inden for en hårsbredde – retsmedicinsk identifikation af enkeltfarvet hårstrå nu muligtEn oversigt over de analytiske teknikker, der er brugt i denne undersøgelse, som tilsammen gør det muligt at skelne mellem to enkeltstrå farvet hår. Kredit:Shinsuke Kunimura fra Tokyo University of Sc
Inden for en hårsbredde – retsmedicinsk identifikation af enkeltfarvet hårstrå nu muligtEn oversigt over de analytiske teknikker, der er brugt i denne undersøgelse, som tilsammen gør det muligt at skelne mellem to enkeltstrå farvet hår. Kredit:Shinsuke Kunimura fra Tokyo University of Sc -
 Akemikere låser op for hemmeligheder bag smeltede salteComputerkemiker Yu Shi fra University of Cincinnati. Kredit:Andrew Higley, University of Cincinnati En kemiker ved University of Cincinnati har fundet på en ny måde at studere de termodynamiske ege
Akemikere låser op for hemmeligheder bag smeltede salteComputerkemiker Yu Shi fra University of Cincinnati. Kredit:Andrew Higley, University of Cincinnati En kemiker ved University of Cincinnati har fundet på en ny måde at studere de termodynamiske ege
- Hvordan løste opdagelsen af, at masse er en form for energi, debatten om Jordens alder?
- Fluorescerende jungle fitnesscentre lavet af DNA
- Hvorfor er det vigtigt at udnytte solenergi?
- Videnskabsmænd, her er hvordan man bruger mindre plastik
- Plasma thruster:Ny teknologi til fjernelse af rumaffald
- Kræfter eller ting, der forekommer i naturen?


