Calciumsulfidformer, når calcium mister 2 valenselektroner til svovl Hvilken type binding dannes?
* calcium (CA) er et metal i gruppe 2 i den periodiske tabel, hvilket betyder, at det har to valenselektroner. Det har en tendens til at * miste * disse elektroner for at opnå en stabil, ædelgaskonfiguration.
* svovl (r) er en ikke -metal i gruppe 16, hvilket betyder, at den har seks valenselektroner. Det har en tendens til at * få * to elektroner for at opnå en stabil, ædelgaskonfiguration.
Når calcium og svovl reagerer, mister calcium sine to valenselektroner og bliver en positivt ladet ion (Ca²⁺). Svovl får disse to elektroner og bliver en negativt ladet ion (S²⁻). Disse modsatte ladede ioner tiltrækker hinanden elektrostatisk og danner en ionisk binding.
Den resulterende forbindelse, calciumsulfid, er et fast stof med et højt smeltepunkt, typisk for ioniske forbindelser.
 Varme artikler
Varme artikler
-
 Forskere skabte spiselige film til fødevareemballageRammohan Aluru (til venstre) og Grigory Zyryanov (til højre) i forskningsgruppen skabte spiselige madfilm på tangen. Kredit:UrFU / Andrei Fomin En international gruppe af forskere fra Indien og Ru
Forskere skabte spiselige film til fødevareemballageRammohan Aluru (til venstre) og Grigory Zyryanov (til højre) i forskningsgruppen skabte spiselige madfilm på tangen. Kredit:UrFU / Andrei Fomin En international gruppe af forskere fra Indien og Ru -
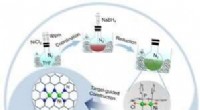 Forskere designer dinuclear-site katalysatorer og afslører den underliggende mekanismeSynteseskema. Kredit:DING Tao et al. Dinuclear-site katalysatorer (DSCer) har tiltrukket sig mere og mere opmærksomhed fra forskere på grund af deres fremragende katalytiske evne ved at inkorporer
Forskere designer dinuclear-site katalysatorer og afslører den underliggende mekanismeSynteseskema. Kredit:DING Tao et al. Dinuclear-site katalysatorer (DSCer) har tiltrukket sig mere og mere opmærksomhed fra forskere på grund af deres fremragende katalytiske evne ved at inkorporer -
 Video:Vampyrfolklore har mere kemi, end du trorKredit:The American Chemical Society Halloween -sæsonen ville ikke være den samme uden de udøde. Denne uge om reaktioner, vi pakker den kemi ud, der måske har inspireret en af vores favoritter:
Video:Vampyrfolklore har mere kemi, end du trorKredit:The American Chemical Society Halloween -sæsonen ville ikke være den samme uden de udøde. Denne uge om reaktioner, vi pakker den kemi ud, der måske har inspireret en af vores favoritter: -
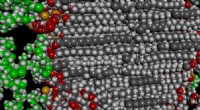 Hudcremer er ikke, hvad vi troede, de varModel af den molekylære struktur af en creme, med atomerne af et overfladeaktivt stof og co-overfladeaktivt stof i lamellen vist i lys og mørkegrå i midten af billedet, og atomer af et konserverings
Hudcremer er ikke, hvad vi troede, de varModel af den molekylære struktur af en creme, med atomerne af et overfladeaktivt stof og co-overfladeaktivt stof i lamellen vist i lys og mørkegrå i midten af billedet, og atomer af et konserverings
- Hvordan kan en kemisk reaktion afgøre, om der er dannet nyt stof?
- Hvad gør mekanisk energi med egne ord?
- Hvad vidste det, at alle dyr har forskellige kromosomer, der fortæller forskere, der arbejder med a…
- Hvad betyder bibelsk anvendelse i et videnskabsmæssigt fair -projekt?
- Er der væsker påvirket af magnetisme?
- Hvilke landformer er i kystsletterne Georgien?


