Hvad er de kemiske egenskaber ved neon?
Kemiske egenskaber ved neon:
Neon er en ædel gas, hvilket betyder, at den er ekstremt ureaktiv og ikke let danner kemiske bindinger. Dette skyldes dens stabile elektronkonfiguration med en fuld ydre skal. Her er nogle vigtige kemiske egenskaber ved neon:
1. Inertness: Neon er det andet mindst reaktive element, der kun er overgået af helium. Det danner ikke nogen stabile kemiske forbindelser under normale forhold.
2. Mangel på oxidationstilstande: På grund af sin inerte natur udviser neon ingen oxidationstilstande.
3. Ingen reaktivitet med andre elementer: Neon reagerer ikke med andre elementer for at danne forbindelser.
4. Ingen ionisering: Neon danner ikke let ioner på grund af dens stabile elektronkonfiguration.
5. Fravær af konventionel kemisk binding: Neon deltager ikke i kovalent eller ionisk binding med andre elementer.
6. Svage Vander Waals Forces: Neon udviser kun svage Vander Waals -kræfter mellem dens atomer, hvilket bidrager til dets lave kogepunkt og gasformige tilstand ved stuetemperatur.
7. Begrænsede kemiske reaktioner: Mens neon er kendt for at være inert, har der været nogle rapporter om dens deltagelse i et par meget usædvanlige reaktioner under ekstreme forhold, som at danne ustabile ioniske arter i en plasmatilstand. Disse er dog ekstremt sjældne og begrænsede.
8. Ingen biologisk rolle: Neon har ingen kendt biologisk rolle.
Generelt domineres de kemiske egenskaber ved neon af dens inerte natur, hvilket gør det til et meget stabilt element med begrænsede kemiske interaktioner. Denne egenskab gør den nyttig i forskellige applikationer, såsom belysning, lasere og kryogenik.
Sidste artikelHvordan fremstiller de kemisk rent ilt?
Næste artikelHvad er de kemiske egenskaber ved gruppe 8 -elementer?
 Varme artikler
Varme artikler
-
 Madras brændbarhedsstandard er en livredder, NIST-rapport finderTestopsætningen beskrevet i 16 CFR Part 1633 indebærer påføring af gasbrænderhoveder på siden og toppen af en madras i op til 30 minutter. Kredit:B. Hayes/NIST Uanset hvor blødt og hyggeligt, se
Madras brændbarhedsstandard er en livredder, NIST-rapport finderTestopsætningen beskrevet i 16 CFR Part 1633 indebærer påføring af gasbrænderhoveder på siden og toppen af en madras i op til 30 minutter. Kredit:B. Hayes/NIST Uanset hvor blødt og hyggeligt, se -
 Sådan måles potentielt skadelige frie radikaler i cigaretrøgKredit:American Chemical Society Rygning af cigaretter kan føre til sygdom og død. Frie radikaler, som er atomer eller grupper af atomer med uparede elektroner, i inhaleret røg menes at være delvi
Sådan måles potentielt skadelige frie radikaler i cigaretrøgKredit:American Chemical Society Rygning af cigaretter kan føre til sygdom og død. Frie radikaler, som er atomer eller grupper af atomer med uparede elektroner, i inhaleret røg menes at være delvi -
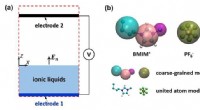 Forskning forbedrer ionfordampningsteorier og ydeevne af elektrosprayapplikationerSkematisk af simuleringssystemet for molekylær dynamik (MD). (til højre) To modeller af BMIM, PF6 bruges i MD -simuleringer. Kredit:JIANG Xikai Elektrospray af ioniske væsker ved stuetemperatur (R
Forskning forbedrer ionfordampningsteorier og ydeevne af elektrosprayapplikationerSkematisk af simuleringssystemet for molekylær dynamik (MD). (til højre) To modeller af BMIM, PF6 bruges i MD -simuleringer. Kredit:JIANG Xikai Elektrospray af ioniske væsker ved stuetemperatur (R -
 3D-printet materiale til erstatning af elfenben til restaurering af artefakterTil højre:Det nye materiale Digory; elfenben til venstre. Kredit:Vienna University of Technology I århundreder, elfenben blev ofte brugt til at lave kunstgenstande. Men for at beskytte elefantpopu
3D-printet materiale til erstatning af elfenben til restaurering af artefakterTil højre:Det nye materiale Digory; elfenben til venstre. Kredit:Vienna University of Technology I århundreder, elfenben blev ofte brugt til at lave kunstgenstande. Men for at beskytte elefantpopu


