Hvorfor danner elementer fra gruppe 1 let forbindelser?
* lav ioniseringsenergi: Alkalimetaller har en lav ioniseringsenergi, hvilket betyder, at det kræver relativt lidt energi for at fjerne deres yderste elektron. Dette gør dem let villige til at opgive denne elektron.
* stor atomstørrelse: Alkalimetaller har store atomradier sammenlignet med andre elementer i deres periode. Dette betyder, at deres valenselektron er længere væk fra kernen og oplever svagere tiltrækning, hvilket gør det lettere at fjerne.
* Dannelse af stabile ioner: Ved at miste deres enkelt valenselektron opnår alkalimetaller en stabil elektronkonfiguration, svarende til de ædle gasser, hvilket gør dem meget stabile.
Hvordan dette fører til dannelse af sammensat:
* Når alkalimetaller reagerer med ikke -metaller, overfører de let deres valenselektron til ikke -metalatomet.
* Denne elektronoverførsel resulterer i dannelsen af en ionisk binding, hvor den positivt ladede metalion (kation) tiltrækkes af den negativt ladede ikke -metale ion (anion).
* Den stærke elektrostatiske attraktion mellem disse ioner fører til dannelse af en stabil ionisk forbindelse.
Eksempel:
Natrium (NA) fra gruppe 1 reagerer med chlor (CL) fra gruppe 17 til dannelse af natriumchlorid (NaCl), et almindeligt bordsalt. Natrium mister let sin ene valenselektron til klor og danner en positivt ladet natriumion (Na+) og en negativt ladet chloridion (Cl-). Disse modsatte ladede ioner tiltrækkes derefter af hinanden og danner den ioniske forbindelse NaCl.
Afslutningsvis gør den lave ioniseringsenergi, stor atomstørrelse og dannelsen af stabile ioner alkalimetaller meget reaktive og let danner forbindelser, især ioniske forbindelser.
Sidste artikelHvad er 83 gram natriumhydroxid i mol?
Næste artikelHvad er americiums reaktivitet?
 Varme artikler
Varme artikler
-
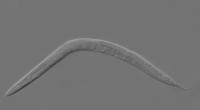 Opdagelsen af livsforlængende vej hos orme viser en ny måde at studere aldring påCaenorhabditis elegans. Kredit:Wikipedia Et enzymblokerende molekyle kan forlænge levetiden for Caenorhabditis elegans rundorme med så meget som 45 procent, hovedsagelig ved at modulere en cannabi
Opdagelsen af livsforlængende vej hos orme viser en ny måde at studere aldring påCaenorhabditis elegans. Kredit:Wikipedia Et enzymblokerende molekyle kan forlænge levetiden for Caenorhabditis elegans rundorme med så meget som 45 procent, hovedsagelig ved at modulere en cannabi -
 Biomedicinske ingeniører skaber smarte bandager til at hele kroniske sårEn UConn -forsker har hjulpet med at udvikle en ny smart bandage, der kan forbedre den kliniske pleje. Kredit:Dr. Ali Tamayol Kroniske og ikke-helende sår - en af de mest ødelæggende komplikatio
Biomedicinske ingeniører skaber smarte bandager til at hele kroniske sårEn UConn -forsker har hjulpet med at udvikle en ny smart bandage, der kan forbedre den kliniske pleje. Kredit:Dr. Ali Tamayol Kroniske og ikke-helende sår - en af de mest ødelæggende komplikatio -
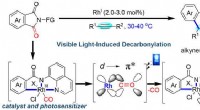 Synligt lys-induceret bifunktionel rhodiumkatalyse udviklet til decarbonylativ kobling af imider med…Lysinduceret bifunktionel rhodiumkatalyse til decarbonylering. Kredit:MIN Xiangting Carbonylgrupper er allestedsnærværende i lægemidler, naturlige produkter, og landbrugskemikalier, især amider. O
Synligt lys-induceret bifunktionel rhodiumkatalyse udviklet til decarbonylativ kobling af imider med…Lysinduceret bifunktionel rhodiumkatalyse til decarbonylering. Kredit:MIN Xiangting Carbonylgrupper er allestedsnærværende i lægemidler, naturlige produkter, og landbrugskemikalier, især amider. O -
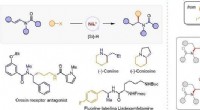 Kirale aminer syntetiseret ved nikkelkatalyseret asymmetrisk reduktiv hydroalkyleringSyntese af chirale alifatiske aminer ved reduktiv hydroalkylering af enamider. Kredit:WANG Jiawang For nylig, en forskergruppe ledet af prof. Fu Yao og associeret forsker Lu Xi fra Hefei National
Kirale aminer syntetiseret ved nikkelkatalyseret asymmetrisk reduktiv hydroalkyleringSyntese af chirale alifatiske aminer ved reduktiv hydroalkylering af enamider. Kredit:WANG Jiawang For nylig, en forskergruppe ledet af prof. Fu Yao og associeret forsker Lu Xi fra Hefei National
- I horisonten:Implantater med indbyggede sensorer, der kan ryste infektion af sig?
- Hvordan kan genetisk drift og genflow påvirke naturlig selektion?
- Hvordan bruger du videnskab i dit daglige liv?
- Model forbedrer forudsigelse af dødelighedsrisiko hos ICU-patienter
- Hvilket mærke af gas indeholder ikke ethonol?
- Nyt anlæg tester energibesparende måde at rense spildevand på


