Forklar hvorfor metaller reagerer med ikke-metaller.?
Her er en sammenbrud:
* Metaller: Metaller har en tendens til at miste elektroner for at opnå en stabil, fyldt elektronskal. De har relativt få elektroner i deres ydre skal, hvilket gør det lettere for dem at give dem op. Denne proces resulterer i dannelsen af positivt ladede ioner (kationer).
* ikke-metaler: Ikke-metaller har på den anden side en tendens til at få elektroner til at opnå en stabil, fyldt elektronskal. De har et stort antal elektroner i deres ydre skal og er tæt på at have en fuld skal. Denne proces resulterer i dannelsen af negativt ladede ioner (anioner).
drivkraften for reaktionen:
Tiltrækningen mellem modsat ladede ioner er drivkraften bag reaktionen mellem metaller og ikke-metaller. Når et metalatom mister et elektron, og et ikke-metalatom får et elektron, tiltrækkes de resulterende ioner stærkt af hinanden og danner en ionisk binding.
Eksempel:
Overvej reaktionen mellem natrium (NA, et metal) og klor (CL, en ikke-metal).
* Natrium har en elektron i sin ydre skal og mister let det for at danne en Na+ -ion.
* Klor har syv elektroner i sin ydre skal og får let et elektron til dannelse af en klodser.
* De resulterende Na+ og Cl-ioner tiltrækkes af hinanden og danner en ionisk forbindelse kaldet natriumchlorid (NaCl), også kendt som tabel salt.
Sammendrag:
I det væsentlige reagerer metaller med ikke-metaller, fordi de kan opnå en mere stabil elektronisk konfiguration ved at overføre elektroner. Denne overførsel resulterer i dannelsen af modsat ladede ioner, der tiltrækkes af hinanden, og danner en ionisk binding.
Sidste artikelHvad er sammensat post?
Næste artikelFormer ilt og klor en ionisk binding?
 Varme artikler
Varme artikler
-
 Biologer opdager carotenoidoverførsel mellem to proteinerCover art til denne artikel minder om coveret til albummet The Dark Side of the Moon af Pink Floyd. Det viser, hvor rødt, lilla, orange og violette proteiner kan fås fra et farveløst protein og en typ
Biologer opdager carotenoidoverførsel mellem to proteinerCover art til denne artikel minder om coveret til albummet The Dark Side of the Moon af Pink Floyd. Det viser, hvor rødt, lilla, orange og violette proteiner kan fås fra et farveløst protein og en typ -
 Ny opdagelse af en så stærk fotobase, det fortjener moniker af superEn ny opdagelse af en lysinduceret superfotobase ved Michigan State University afslører nogle af fotosyntesens ønskelige træk. Det tværfaglige team af forskere var i stand til at dokumentere den super
Ny opdagelse af en så stærk fotobase, det fortjener moniker af superEn ny opdagelse af en lysinduceret superfotobase ved Michigan State University afslører nogle af fotosyntesens ønskelige træk. Det tværfaglige team af forskere var i stand til at dokumentere den super -
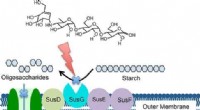 Præcis målretningsteknik kunne regulere tarmbakterier, begrænsende sygdomKredit:American Chemical Society Nye beviser tyder på, at mikrober i fordøjelsessystemet har stor indflydelse på menneskers sundhed og kan spille en rolle i starten af sygdom i hele kroppen. Nu,
Præcis målretningsteknik kunne regulere tarmbakterier, begrænsende sygdomKredit:American Chemical Society Nye beviser tyder på, at mikrober i fordøjelsessystemet har stor indflydelse på menneskers sundhed og kan spille en rolle i starten af sygdom i hele kroppen. Nu, -
 Undersøgelse skyller hudenKAUST-forskere har brugt komplementære teknikker til at adskille rent grænsefladeeffekter fra elektrospray-specifikke effekter. Kredit:Ivan Gromicho Fra den vindpiskede overflade af det åbne hav,
Undersøgelse skyller hudenKAUST-forskere har brugt komplementære teknikker til at adskille rent grænsefladeeffekter fra elektrospray-specifikke effekter. Kredit:Ivan Gromicho Fra den vindpiskede overflade af det åbne hav,
- Hvordan finter man oxidationstallet i en reaktion?
- Alibaba viser automatisk vinbutik i Hong Kong
- Bilindustrien har problemer med Ford, Jaguar Land Rover
- Uddybende spørgsmål:Hvad betyder 'virksomhedskultur'?
- Hvad er statsjord?
- Computer science college seniorer i USA klarer sig bedre end jævnaldrende i Kina, Indien og Rusland…


