Hvad er antallet af kovalente bindinger i 8 g metan?
1. Bestem den molekylære formel af metan:
* Metanes kemiske formel er ch₄. Dette betyder, at hvert metanmolekyle har 1 carbonatom og 4 hydrogenatomer.
2. Tæl de kovalente bindinger i et metanmolekyle:
* Kulstof danner fire enkelt kovalente bindinger med fire hydrogenatomer.
3. Beregn antallet af metanmolekyler i 8 g:
* Find den molære masse af metan: 12,01 g/mol (c) + 4 * 1,01 g/mol (H) =16,05 g/mol
* Beregn antallet af mol: 8 g / 16,05 g / mol =0,498 mol
* Brug Avogadros nummer til at finde antallet af molekyler: 0,498 mol * 6,022 x 10²³ molekyler/mol ≈ 3,00 x 10²³ molekyler
4. Beregn det samlede antal kovalente obligationer:
* obligationer pr. Molekyle: 4 bindinger/molekyle
* Samlede obligationer: (3,00 x 10²³ molekyler) * (4 bindinger/molekyle) = 1,20 x 10²⁴ kovalente bindinger
Derfor er der ca. 1,20 x 10²⁴ kovalente bindinger i 8 g metan.
 Varme artikler
Varme artikler
-
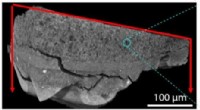 Forskere udforsker gammel maling i mikroskopiske detaljer for at informere bevaringsindsatsenEn røntgenmikrotomografiskanning af en malingsprøve (til venstre) viser en tilfældig fordeling af komponenter i en malingsprøve, og en zoomet visning ved hjælp af en teknik kendt som fototermisk induc
Forskere udforsker gammel maling i mikroskopiske detaljer for at informere bevaringsindsatsenEn røntgenmikrotomografiskanning af en malingsprøve (til venstre) viser en tilfældig fordeling af komponenter i en malingsprøve, og en zoomet visning ved hjælp af en teknik kendt som fototermisk induc -
 De stiveste porøse letvægtsmaterialer nogensindePladegitter er det valgmæssige design til fremtidige lette porøse materialer. Kredit:ETH Zürich / Marc Day Forskere ved ETH har udviklet og fremstillet en familie af arkitekturer, der maksimerer s
De stiveste porøse letvægtsmaterialer nogensindePladegitter er det valgmæssige design til fremtidige lette porøse materialer. Kredit:ETH Zürich / Marc Day Forskere ved ETH har udviklet og fremstillet en familie af arkitekturer, der maksimerer s -
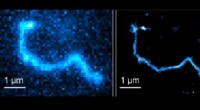 Nye træk for polymerkædedynamikSuperopløsnings fluorescensmikroskopi (højre) giver betydeligt skarpere billeder sammenlignet med konventionel fluorescensmikroskopi. Kredit:Abadi et al. En teknik, der gør det muligt for forskere
Nye træk for polymerkædedynamikSuperopløsnings fluorescensmikroskopi (højre) giver betydeligt skarpere billeder sammenlignet med konventionel fluorescensmikroskopi. Kredit:Abadi et al. En teknik, der gør det muligt for forskere -
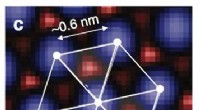 Scanning af overfladen af lithiumtitanatDen tredobbelte symmetri, der er angivet her, afslører spinelkrystalstrukturen. Kredit:Taro Hitosugi, Naturkommunikation Forskere ved Tokyo Institute of Technology, Tohoku University og Universi
Scanning af overfladen af lithiumtitanatDen tredobbelte symmetri, der er angivet her, afslører spinelkrystalstrukturen. Kredit:Taro Hitosugi, Naturkommunikation Forskere ved Tokyo Institute of Technology, Tohoku University og Universi
- Succession, der opstår, hvor planter ikke har vokset før kaldes?
- Hvad er niveauerne for organisation inden for biologi?
- Interaktivt softwareværktøj gør komplekst formdesign enkelt
- Hvornår gik Apollo -rumskibet til månen?
- Tynd linse med variabelt fokus designet til augmented og virtual reality-headset
- En ny klasse af antibiotikakandidater til bekæmpelse af superbugs


