Hvad sker der, når hydrofluorinsyreopløsning reageres med en lithiumhydroxidopløsning?
Her er den afbalancerede kemiske ligning:
hf (aq) + lioh (aq) → LIF (aq) + h₂o (l)
Forklaring:
* hydrofluorinsyre (HF) er en svag syre, hvilket betyder, at den kun delvist ioniserer i opløsningen.
* lithiumhydroxid (lioh) er en stærk base, hvilket betyder, at den helt ioniserer i opløsningen.
* Når de to opløsninger er blandet, reagerer hydrogenionerne (H⁺) fra HF med hydroxidionerne (OH⁻) fra LioH til dannelse af vand (H₂O).
* De resterende ioner, lithium (Li⁺) og fluorid (F⁻), kombineres for at danne lithiumfluorid (LIF), som forbliver opløst i opløsningen.
Vigtig note:
Selvom denne reaktion er en standardneutraliseringsreaktion, er det vigtigt at huske, at hydrofluorinsyre er meget ætsende og farlig. Det kan forårsage alvorlige forbrændinger og endda død, hvis de ikke håndteres korrekt. Det er vigtigt at bruge korrekte sikkerhedsforholdsregler og beskyttelsesudstyr, når man arbejder med hydrofluorinsyre.
 Varme artikler
Varme artikler
-
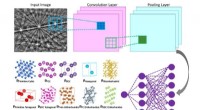 Maskinlæringsteknik fremskynder bestemmelse af krystalstrukturIllustration af den indre funktion af et konvolutionelt neuralt netværk, der beregner sandsynligheden for, at inputdiffraktionsmønsteret tilhører en given klasse (f.eks. Bravais-gitter eller rumgruppe
Maskinlæringsteknik fremskynder bestemmelse af krystalstrukturIllustration af den indre funktion af et konvolutionelt neuralt netværk, der beregner sandsynligheden for, at inputdiffraktionsmønsteret tilhører en given klasse (f.eks. Bravais-gitter eller rumgruppe -
 Ændring af silkeorms diæt til at spinde stærkere silkeSilkeormen og dens CNF-holdige foder. Kredit:Tohoku University Tohoku University forskere har produceret cellulose nanofiber (CNF) syntetiseret silke naturligt gennem en simpel tweak til silkeorms
Ændring af silkeorms diæt til at spinde stærkere silkeSilkeormen og dens CNF-holdige foder. Kredit:Tohoku University Tohoku University forskere har produceret cellulose nanofiber (CNF) syntetiseret silke naturligt gennem en simpel tweak til silkeorms -
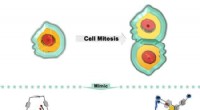 Forskere afslører gæstereaktionsdrevet bur til sammenkoblet tvillingbur, mitose-lignende værtstra…Skematisk illustration af gæstereaktion induceret mitose-lignende værtstransformation fra Pd 4 L 2 bur til en sammenføjet Pd 6 L 3 tvillingebur. Kredit:Prof. SUNs gruppe Styret af den indu
Forskere afslører gæstereaktionsdrevet bur til sammenkoblet tvillingbur, mitose-lignende værtstra…Skematisk illustration af gæstereaktion induceret mitose-lignende værtstransformation fra Pd 4 L 2 bur til en sammenføjet Pd 6 L 3 tvillingebur. Kredit:Prof. SUNs gruppe Styret af den indu -
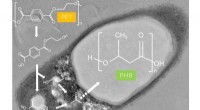 Hvordan en bakterie kan hjælpe med at løse plastikforureningskrisenI. sakaiensis dyrket på poly (ethylenterephthalat) (PET) akkumulerer poly (3-hydroxybutyrat) (PHB). Kredit:Shosuke Yoshida Plastforurening er et af de mest presserende miljøspørgsmål i vores tid.
Hvordan en bakterie kan hjælpe med at løse plastikforureningskrisenI. sakaiensis dyrket på poly (ethylenterephthalat) (PET) akkumulerer poly (3-hydroxybutyrat) (PHB). Kredit:Shosuke Yoshida Plastforurening er et af de mest presserende miljøspørgsmål i vores tid.
- Hvad er genstande skabt og brugt af mennesker?
- Ingeniører, zoologer afslører, hvordan måger vinge form for stabil svævning
- Lys- og kobberkatalyse forbedrer aminsyntesen
- Hvor findes de yngste klipper?
- Hvor stærk er Mars -tyngdekraften sammenlignet med jorden?
- GPM fanger række af stærke storme, der er ansvarlige for tornadoer i det østlige USA


