Løsninger, der er kendetegnet ved dannelsen af hydroxidioner OH er?
Her er hvorfor:
* ph -skala: PH -skalaen måler surhedsgraden eller alkaliniteten af en opløsning. En pH på 7 er neutral. Værdier under 7 er sure, og værdier over 7 er basale (alkaliske).
* Hydroxidioner: Hydroxidioner (OH-) er ansvarlige for alkaliniteten af en opløsning. Jo højere koncentration af hydroxidioner er, desto mere grundlæggende er opløsningen.
* Hydrogenioner: Omvendt har sure opløsninger en højere koncentration af brintioner (H+).
Eksempler på grundlæggende løsninger:
* natriumhydroxid (NaOH) :Almindeligt kendt som lut, det er en stærk base, der adskiller sig fuldstændigt i vand for at producere hydroxidioner.
* kaliumhydroxid (KOH): I lighed med natriumhydroxid er det en anden stærk base.
* ammoniak (NH3): Dette er en svag base, der reagerer med vand til dannelse af hydroxidioner.
Vigtig note: Dannelsen af hydroxidioner (OH-) er en nøgleegenskab ved basale opløsninger, men ikke alle grundlæggende løsninger danner dem direkte. Nogle baser reagerer med vand for at producere hydroxidioner.
Sidste artikelEr klorgas en homogen blanding?
Næste artikelEr bagepulver en ionisk eller molekylær forbindelse?
 Varme artikler
Varme artikler
-
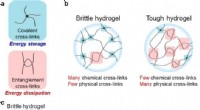 En universel metode til nemt at designe seje og strækbare hydrogelerSkema af hydrogeler med fysiske og kemiske tværbindinger. (a) Kovalente og sammenfiltrede tværbindinger til energilagring og -dissipation, henholdsvis. (b) Kemisk og fysisk tværbundne strukturer af sk
En universel metode til nemt at designe seje og strækbare hydrogelerSkema af hydrogeler med fysiske og kemiske tværbindinger. (a) Kovalente og sammenfiltrede tværbindinger til energilagring og -dissipation, henholdsvis. (b) Kemisk og fysisk tværbundne strukturer af sk -
 Syntetiske brændstoffer kan mindske CO2-fodaftrykketKredit:CC0 Public Domain Syntetiske brændstoffer, lavet ved hjælp af kulstof fanget fra luften, landbrugsaffald eller biomasse, kunne hjælpe transportsektoren med at reducere sin afhængighed af fo
Syntetiske brændstoffer kan mindske CO2-fodaftrykketKredit:CC0 Public Domain Syntetiske brændstoffer, lavet ved hjælp af kulstof fanget fra luften, landbrugsaffald eller biomasse, kunne hjælpe transportsektoren med at reducere sin afhængighed af fo -
 Forskning finder alvorlige problemer med retsmedicinsk softwareKredit:CC0 Public Domain Ny forskning fra North Carolina State University og University of South Florida finder betydelige fejl i nyligt frigivet retsmedicinsk software designet til at vurdere ind
Forskning finder alvorlige problemer med retsmedicinsk softwareKredit:CC0 Public Domain Ny forskning fra North Carolina State University og University of South Florida finder betydelige fejl i nyligt frigivet retsmedicinsk software designet til at vurdere ind -
 Foto-induceret ionforskydning i blandede halogenidperovskitter til et batteri, der kan oplades direk…PL-emissionskortlægning af MA0.17FA0.83Pb(I0.5Br0.5)3 ved detektionsbølgelængden på 670 nm og 790 nm efter lokal belysning i 1 time med en strålestørrelse på ~ 1 mm og tæthed på 1 sol på den bare film
Foto-induceret ionforskydning i blandede halogenidperovskitter til et batteri, der kan oplades direk…PL-emissionskortlægning af MA0.17FA0.83Pb(I0.5Br0.5)3 ved detektionsbølgelængden på 670 nm og 790 nm efter lokal belysning i 1 time med en strålestørrelse på ~ 1 mm og tæthed på 1 sol på den bare film
- Der kan være en stor fejl i britisk fracking-håb – geologien
- Banebrydende opdagelse inden for diagnostiske værktøjer, der kan erstatte almindeligt anvendte og …
- Bekæmpelse af luftforurening:Forskere præsenterer emissionsopgørelse for Nepal
- At skabe meningsfuld forandring i byer tager årtier, ikke år, og starter fra bunden
- Hvor findes de fleste fossiler i Virginia?
- Røg fra naturbrand kan have forstærket den arktiske planteplanktonopblomstring


