Hvor mange nitrogenatomer er i 10,2 g kobber (II) nitrat?
1. Bestem formlen for kobber (II) nitrat:
* Kobber (II) har en +2 ladning (Cu²⁺).
* Nitrat har en -1 -ladning (ingen₃⁻).
* For at afbalancere ladningerne har vi brug for to nitrationer for hvert kobber (II) ion. Formlen er Cu (ingen₃) ₂.
2. Beregn den molære masse af kobber (II) nitrat:
* CU:63,55 g/mol
* N:14,01 g/mol (x2 fordi der er to nitrogenatomer)
* O:16,00 g/mol (x6 fordi der er seks iltatomer)
* Molmasse =63,55 + (14,01 x 2) + (16,00 x 6) =187,57 g/mol
3. Beregn antallet af mol kobber (II) nitrat:
* Mol =masse / molær masse
* Mol =10,2 g / 187,57 g / mol =0,0544 mol
4. Beregn antallet af mol nitrogenatomer:
* Da der er to nitrogenatomer pr. Formelenhed for kobber (II) nitrat, er der dobbelt så mange mol nitrogenatomer som mol kobber (II) nitrat.
* Mol nitrogen =0,0544 mol Cu (NO₃) ₂ * 2 mol N / 1 mol Cu (NO₃) ₂ =0,1088 mol N
5. Beregn antallet af nitrogenatomer:
* Brug Avogadros nummer (6.022 x 10²³ atomer/mol) til at konvertere mol til atomer.
* Antal nitrogenatomer =0,1088 mol N * 6,022 x 10²³ atomer/mol =6,55 x 10²² atomer
Derfor er der ca. 6,55 x 10²² nitrogenatomer i 10,2 g kobber (II) nitrat.
Sidste artikelHvad er hydroxidionkoncentrationen af en opløsning, der har pH 8,57?
Næste artikelHvad er pH for neutral jord?
 Varme artikler
Varme artikler
-
 Ny polymer hærder og ændrer farve ved mekanisk belastningSegmenterede polyurethaner (SPUer), der indeholder di-fluorenylsuccinonitril (DFSN) dele og methacryloylgrupper, blev syntetiseret. De opnåede elastomerer genererede lyserøde cyanofluorenradikaler og
Ny polymer hærder og ændrer farve ved mekanisk belastningSegmenterede polyurethaner (SPUer), der indeholder di-fluorenylsuccinonitril (DFSN) dele og methacryloylgrupper, blev syntetiseret. De opnåede elastomerer genererede lyserøde cyanofluorenradikaler og -
 Nyopdaget kobber- og grafitkombination kan føre til mere effektive lithium-ion-batterierEn første af sin slags kobber- og grafitkombination, der blev opdaget i grundlæggende energiforskning ved det amerikanske energiministeriums Ames Laboratory, kunne have konsekvenser for at forbedre en
Nyopdaget kobber- og grafitkombination kan føre til mere effektive lithium-ion-batterierEn første af sin slags kobber- og grafitkombination, der blev opdaget i grundlæggende energiforskning ved det amerikanske energiministeriums Ames Laboratory, kunne have konsekvenser for at forbedre en -
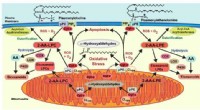 Hvad sker der med plasmalogener, fosfolipiderne ingen kan lide at tænke påDiagram viser signalveje påvirket af cytochrom cs nedbrydning af plasmalogen. Kredit:Richard Gross Patienter med Alzheimers sygdom mister op til 60 % af en komponent kaldet plasmalogen fra membran
Hvad sker der med plasmalogener, fosfolipiderne ingen kan lide at tænke påDiagram viser signalveje påvirket af cytochrom cs nedbrydning af plasmalogen. Kredit:Richard Gross Patienter med Alzheimers sygdom mister op til 60 % af en komponent kaldet plasmalogen fra membran -
 Hvordan tyktarmen prioriterer gasdetox frem for energiforbrugKredit:CC0 Public Domain Løg, kål, hvidløg. Selvom det er nærende, at spise disse fødevarer kan føre til en pinlig bivirkning:ildelugtende luft i maven. Mere end bare ildelugtende, svovlbrinte, de
Hvordan tyktarmen prioriterer gasdetox frem for energiforbrugKredit:CC0 Public Domain Løg, kål, hvidløg. Selvom det er nærende, at spise disse fødevarer kan føre til en pinlig bivirkning:ildelugtende luft i maven. Mere end bare ildelugtende, svovlbrinte, de
- Hvordan kan du skelne stærk syre fra en svag ved hjælp af en indikator?
- byer, stammer prøver en ny miljøtilgang:Giv naturrettigheder
- Hvilken Landform beskriver bedst skove?
- Sommersolen på den nordlige halvkugle stiger fra?
- Hvad hedder kerner, der flankerer æg i en kvindelig gametophyt?
- Forskere udvikler ny test til at opdage sygdom og infektion


