Hvilken har polære kovalente bindinger cl2 Cao N2 eller SO2?
* polære kovalente obligationer: Forekommer, når to atomer med forskellige elektroniske elektroner med elektronegativitet deler. Den mere elektronegative atom trækker de delte elektroner tættere, hvilket skaber en delvis negativ ladning (Δ-) på det atom og en delvis positiv ladning (Δ+) på det andet atom.
Lad os analysere hvert molekyle:
* cl₂ (klorgas): Kloratomer har den samme elektronegativitet. Bindingen er ikke -polær kovalent.
* CAO (calciumoxid): Calcium er et metal, og ilt er en ikke -metal. Dette danner en ionisk binding, ikke en polær kovalent binding.
* n₂ (nitrogengas): Nitrogenatomer har den samme elektronegativitet. Bindingen er ikke -polær kovalent.
* so₂ (svovldioxid): Svovl og ilt har forskellige elektronegativiteter (ilt er mere elektronegativ). Dette skaber polære kovalente bindinger mellem svovl og hvert iltatom.
Derfor har So₂ (svovldioxid) polære kovalente bindinger.
Sidste artikelKan nitrogen og klor danne kovalente bindinger?
Næste artikelChlor er en meget reaktiv gas?
 Varme artikler
Varme artikler
-
 Instrument på BESSY II viser, hvordan lys aktiverer molybdændisulfidlag til at blive katalysatorerEt nyt instrument på BESSY II kan bruges til at studere molybdænsulfid tynde film, der er af interesse som katalysatorer for solenergiproduktion. En lysimpuls udløser en faseovergang fra den halvleden
Instrument på BESSY II viser, hvordan lys aktiverer molybdændisulfidlag til at blive katalysatorerEt nyt instrument på BESSY II kan bruges til at studere molybdænsulfid tynde film, der er af interesse som katalysatorer for solenergiproduktion. En lysimpuls udløser en faseovergang fra den halvleden -
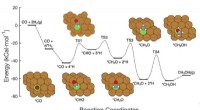 Machine learning framework ID'er mål til forbedring af katalysatorerDenne grafik viser syvtrins reaktionsvejen for CO-hydrogenering til methanol over kobberbaserede katalysatorer, inklusive reaktanterne på hvert trin, skematiske atomarrangementer af mellemprodukterne
Machine learning framework ID'er mål til forbedring af katalysatorerDenne grafik viser syvtrins reaktionsvejen for CO-hydrogenering til methanol over kobberbaserede katalysatorer, inklusive reaktanterne på hvert trin, skematiske atomarrangementer af mellemprodukterne -
 Forskere gør grøn kemi frem med ny katalysator til reduktion af kuldioxidKredit:CC0 Public Domain Forskere ved Oregon State University har gjort et vigtigt fremskridt i den grønne kemi stræben efter at omdanne drivhusgassen kuldioxid til genanvendelige former for kulst
Forskere gør grøn kemi frem med ny katalysator til reduktion af kuldioxidKredit:CC0 Public Domain Forskere ved Oregon State University har gjort et vigtigt fremskridt i den grønne kemi stræben efter at omdanne drivhusgassen kuldioxid til genanvendelige former for kulst -
 Forskere finder en billigere måde at oplyse OLED-skærme påKemiker Mark E. Thompson har nye kobberbaserede lysdioder opfundet af ham og et team af kemikere, der kunne være en billigere løsning for tv- og smartphone-skærme til at producere farven-herunder blå-
Forskere finder en billigere måde at oplyse OLED-skærme påKemiker Mark E. Thompson har nye kobberbaserede lysdioder opfundet af ham og et team af kemikere, der kunne være en billigere løsning for tv- og smartphone-skærme til at producere farven-herunder blå-
- Hvad er denne 149 millioner kilometer i AU?
- Hvordan forsvarer kejserpingvinerne sig selv?
- Hvordan fungerer et elektrisk jern?
- Rasende australske skovbrande ramte Sydneys forstæder
- Ultra-diffus galakse F8D1 har en gigantisk tidevandshale, observationer finder
- WhatsApp forbyder europæiske under 16 år at bruge app


