Hvad sker der, når elektron kommer tæt på valensskallen af et fluoratom?
1. Afvisning:
* Hvis elektronet hører til et andet atom: Elektronet vil opleve stærk elektrostatisk frastødning fra de negativt ladede elektroner, der allerede besætter Fluoras Valence Shell. Denne frastødning forhindrer elektronet i let at komme ind i valensskallen og danne en kemisk binding.
* Hvis elektronet allerede er i Valence Shell: Elektronet holdes tæt af den stærke tiltrækning af fluorens kerne, og det vil modstå at blive trukket væk fra atomet.
2. Binding:
* Hvis elektronet har nok energi og tiltrækkes af fluoratomet: Elektronet kan overvinde frastødningen og trækkes ind i fluorens valensskal. Denne proces kaldes elektrongevinst og resulterer i dannelsen af en fluoridion (f-) . Denne proces frigiver energi og er meget eksoterm, hvilket gør fluor til et meget elektronegativt element.
3. Excitation:
* Hvis elektronet har lige nok energi: Det kan midlertidigt besætte et højere energiniveau inden for valensskallen. Dette kaldes excitation . Denne tilstand er ustabil, og elektronet falder hurtigt tilbage til sit oprindelige energiniveau og frigiver den overskydende energi som lys.
For at opsummere, når et elektron kommer tæt på valensskallen af et fluoratom, kan det opleve frastødelse, danne en binding eller være ophidset. Det specifikke resultat afhænger af elektronens energi og oprindelse.
Det er vigtigt at huske, at fluor har en meget stærk attraktion for elektroner på grund af dens høje elektronegativitet, hvilket gør det meget reaktivt og sandsynligvis får elektroner for at opnå en stabil octet -konfiguration.
Sidste artikelHvilke metaller reagerer ikke med vandsyrer eller ilt?
Næste artikelHvad er det kemiske navn på PT3 (PO3) 4?
 Varme artikler
Varme artikler
-
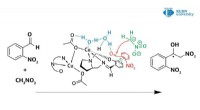 Vand spiller en afgørende rolle i mekanismen for Henry-reaktionen katalyseret af nye kobberkompleks…Kredit:RUDN Universitet En kemiker fra RUDN University reviderede mekanismen for Henry-reaktionen katalyseret af kobber(II)-komplekser. Dermed, ved hjælp af nye kobber(II)-komplekser opnået i samm
Vand spiller en afgørende rolle i mekanismen for Henry-reaktionen katalyseret af nye kobberkompleks…Kredit:RUDN Universitet En kemiker fra RUDN University reviderede mekanismen for Henry-reaktionen katalyseret af kobber(II)-komplekser. Dermed, ved hjælp af nye kobber(II)-komplekser opnået i samm -
 Løsning af plastikmanglen med en ny kemisk katalysatorKredit:CC0 Public Domain I et år, der allerede har ramt produktionsforsyningskæder, endnu en mangel komplicerer producenters og forbrugeres liv:plastik, og fødevareemballagen, bilkomponenter, tøj,
Løsning af plastikmanglen med en ny kemisk katalysatorKredit:CC0 Public Domain I et år, der allerede har ramt produktionsforsyningskæder, endnu en mangel komplicerer producenters og forbrugeres liv:plastik, og fødevareemballagen, bilkomponenter, tøj, -
 Nyt materiale kan opfange giftige forurenende stoffer fra luftenProfessor Michael Zaworotko, Bernal formand for Crystal Engineering and Science Foundation of Ireland Research Professor ved University of Limericks Bernal Institute. Nedenfor Dr. Xiang-Jing Kong fra
Nyt materiale kan opfange giftige forurenende stoffer fra luftenProfessor Michael Zaworotko, Bernal formand for Crystal Engineering and Science Foundation of Ireland Research Professor ved University of Limericks Bernal Institute. Nedenfor Dr. Xiang-Jing Kong fra -
 Syntetiske biologer hacker bakteriesensorerFor at opdage funktionen af et helt nyt to-komponent system, Rice Universitys syntetiske biologer omkoblede det genetiske kredsløb i syv bakteriestammer og undersøgte, hvordan hver enkelt opførte si
Syntetiske biologer hacker bakteriesensorerFor at opdage funktionen af et helt nyt to-komponent system, Rice Universitys syntetiske biologer omkoblede det genetiske kredsløb i syv bakteriestammer og undersøgte, hvordan hver enkelt opførte si
- Hvilke landformer kan dannes uafhængige af pladegrænser?
- Håndtryk eller kontrakter?
- Er lysfarvede klipper med lavere densiteter fra basaltisk magma?
- Hvilket ord beskriver bedst solen?
- Brug af kunstig intelligens til opdagelse af lægemidler viser hurtighed, men tiltrækker diskussion…
- Du kan få for meget af det gode, siger undersøgelse af finansielle analytikere balance mellem arbe…


