En synteseaktion vil forekomme spontant, hvis dannelsesproduktets varme er?
* dannelsesvarme: Formationsvarmen (ΔHF °) af en forbindelse er ændringen i entalpi, der opstår, når en mol af forbindelsen dannes fra dens bestanddele i deres standardtilstande. En negativ ΔHF ° indikerer, at dannelsen af forbindelsen frigiver varme, hvilket gør den til en eksoterm proces.
* spontane reaktioner: Spontane reaktioner er dem, der forekommer uden behov for ekstern energiindgang. I kemisk termer er en spontan reaktion termodynamisk gunstig, hvilket betyder, at det resulterer i et fald i Gibbs -fri energi (ΔG <0).
* Tilslutning af prikkerne: En negativ ΔHF ° for et produkt betyder normalt, at reaktionen, der danner det, er eksoterme (frigiver varme). Eksoterme reaktioner har en tendens til at have en negativ ΔG, hvilket gør dem spontane.
Vigtig note: Mens en negativ ΔHF ° stærkt antyder en spontan reaktion, er det ikke den eneste faktor. Den samlede spontanitet af en reaktion afhænger af både entalpiændringen (ΔH) og entropiændringen (ΔS) i henhold til ligningen:
ΔG =ΔH - TΔS
Hvor:
* ΔG er ændringen i Gibbs Free Energy
* T er temperaturen i Kelvin
Selv hvis ΔHF ° er negativt, kunne et signifikant fald i entropi (ΔS) gøre det samlede ΔG -positive, hvilket forhindrer spontanitet.
Sidste artikelHvad refererer til arrangementet og antallet af mindre partikler i et atom?
Næste artikelHvad inkluderer metaller?
 Varme artikler
Varme artikler
-
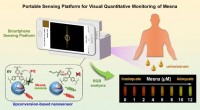 Opkonverteringsbaseret nanosensor udviklet til påvisning af kemoterapilægemidlerFigur 1. Bærbar sensorplatform til visuel kvantitativ overvågning af mesna. Kredit:Hu Bin Som en vigtig regional modgift til at beskytte urinsystemet hos kemoterapipatienter skal mesna (et lægemidd
Opkonverteringsbaseret nanosensor udviklet til påvisning af kemoterapilægemidlerFigur 1. Bærbar sensorplatform til visuel kvantitativ overvågning af mesna. Kredit:Hu Bin Som en vigtig regional modgift til at beskytte urinsystemet hos kemoterapipatienter skal mesna (et lægemidd -
 Katalysatorforskning for solbrændstoffer:Amorft molybdænsulfid fungerer bedstSEM viser Molybdænsulfid aflejret ved stuetemperatur. Kredit:HZB Effektive og billige katalysatorer vil være nødvendige for produktion af brint fra sollys. Molybdænsulfider betragtes som gode kand
Katalysatorforskning for solbrændstoffer:Amorft molybdænsulfid fungerer bedstSEM viser Molybdænsulfid aflejret ved stuetemperatur. Kredit:HZB Effektive og billige katalysatorer vil være nødvendige for produktion af brint fra sollys. Molybdænsulfider betragtes som gode kand -
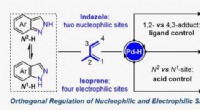 Ortogonal reguleringsstrategi giver nye muligheder for opbygning af molekylær kompleksitetPd-katalytisk regiodivergent dimethylallylering af indazol med isopren. Kredit:JIANG Wenshuang og JI Dingwei Dimethylallyl-relaterede enheder spiller en væsentlig rolle i at øge lipofilicitet af m
Ortogonal reguleringsstrategi giver nye muligheder for opbygning af molekylær kompleksitetPd-katalytisk regiodivergent dimethylallylering af indazol med isopren. Kredit:JIANG Wenshuang og JI Dingwei Dimethylallyl-relaterede enheder spiller en væsentlig rolle i at øge lipofilicitet af m -
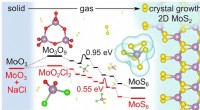 Undersøgelsesdetaljer, hvorfor 2D-molybdændisulfiddannelse får et hastighedsboost fra saltAlmindelig salt (NaCl) fungerer som et mellemled i den kemiske dampaflejringsvækst af 2D molybdændisulfid, hvilket fremskynder processen med dets skabelse. Materialeteoretikere ved Rice University opd
Undersøgelsesdetaljer, hvorfor 2D-molybdændisulfiddannelse får et hastighedsboost fra saltAlmindelig salt (NaCl) fungerer som et mellemled i den kemiske dampaflejringsvækst af 2D molybdændisulfid, hvilket fremskynder processen med dets skabelse. Materialeteoretikere ved Rice University opd
- Hvad er nogle grunde til, at videnskab ikke er vigtig?
- Hvem kontrollerer hvem:Alger eller søanemone?
- Hvad er filosofien om at have minimal indflydelse på miljøopkald?
- Hvor mange kilometer er 9,54 astronomiske enheder?
- Er isobutan et godt eksempel på forgrenet kulbrinte?
- Hvorfor de første amerikanske klimaafsløringsregler er meget svagere end planlagt, og hvad de bety…


