Når 1,0 mol nitrogen reagerer med 3,0 brint til dannelse af 2,0 af ammoniak, er den frigjorte energi 92 kJ Hvor meget hvis 0,42 reagerer?
1. Forstå reaktionen:
Den afbalancerede kemiske ligning for reaktionen er:
N₂ (g) + 3H₂ (g) → 2nh₃ (g) + 92 kJ
Dette fortæller os, at 1 mol nitrogen reagerer med 3 mol brint til at producere 2 mol ammoniak, der frigiver 92 kJ energi.
2. Bestem den frigivne energi pr. Mol nitrogen:
Da 92 kJ frigøres for 1 mol nitrogen, er energien, der er frigivet pr. Mol nitrogen, 92 kJ/mol.
3. Beregn energien frigivet for 0,42 mol nitrogen:
For at finde energien, der er frigivet til 0,42 mol nitrogen, skal du multiplicere energien pr. Mol med antallet af mol:
Energi frigivet =(92 kJ/mol) * (0,42 mol) = 38,64 kJ
Derfor ville 38,64 kJ energi blive frigivet, når 0,42 mol nitrogen reagerer med brint til dannelse af ammoniak.
Sidste artikelOxygen som et almindeligt oxidationsmiddel?
Næste artikelKan kaliumstøtte thorium kemisk reaktion?
 Varme artikler
Varme artikler
-
 Fuldt identificeret - protonernes vejMartin Winkler, Jifu Duan og Thomas Happe (fra venstre) sporede protonernes vej helt ind i det aktive center af hydrogenaser. Kredit:RUB, Marquard I deres katalytiske center, hydrogenaser fremstil
Fuldt identificeret - protonernes vejMartin Winkler, Jifu Duan og Thomas Happe (fra venstre) sporede protonernes vej helt ind i det aktive center af hydrogenaser. Kredit:RUB, Marquard I deres katalytiske center, hydrogenaser fremstil -
 Kemisk syntese kunne producere mere potente antibiotikaKredit:CC0 Public Domain Ved at bruge en ny type kemisk reaktion, MIT-forskere har vist, at de kan modificere antibiotika på en måde, der potentielt kan gøre dem mere effektive mod lægemiddelresis
Kemisk syntese kunne producere mere potente antibiotikaKredit:CC0 Public Domain Ved at bruge en ny type kemisk reaktion, MIT-forskere har vist, at de kan modificere antibiotika på en måde, der potentielt kan gøre dem mere effektive mod lægemiddelresis -
 Videnskabelige fremskridt kan gøre det lettere at genanvende plastKredit:CC0 Public Domain De fleste af de 150 millioner tons plastik, der produceres rundt om i verden hvert år, ender på lossepladser, havene og andre steder. Mindre end 9 procent af plasten genan
Videnskabelige fremskridt kan gøre det lettere at genanvende plastKredit:CC0 Public Domain De fleste af de 150 millioner tons plastik, der produceres rundt om i verden hvert år, ender på lossepladser, havene og andre steder. Mindre end 9 procent af plasten genan -
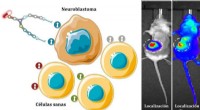 Syntetiske molekyler leverer lægemidler direkte til neuroblastomcellerKredit:Angewandte Chemie-International Edition 58 (2019) Forskere fra Universidad Politécnica de Madrid er involveret i udviklingen af specifikke molekylære stilladser, som er i stand til at lev
Syntetiske molekyler leverer lægemidler direkte til neuroblastomcellerKredit:Angewandte Chemie-International Edition 58 (2019) Forskere fra Universidad Politécnica de Madrid er involveret i udviklingen af specifikke molekylære stilladser, som er i stand til at lev


